(一) A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/l。反应进行2min后A的浓度为0.8mol/l, B的浓度为0.6mol/l, C的浓度为0.6mol/l。则2min内反应的平均速率为v(A)= ,v (B) = ,v(C)= 。该反应的化学反应方程式为: 。
(二) 比较下列各组热化学方程式中的ΔH的大小关系。
(1)已知1 mol白磷转化成红磷,放出18.39 kJ的热量,又知:①P4 (白,s)+5O2(g)=2P2O5(s) ΔH1,
②4P(红,s)+5O2(g)=2P2O5(s) ΔH2。
则ΔH1和ΔH2的关系:ΔH1 ΔH2
(2)③ S(g)+O2(g)==SO2(g) △H1
④S(s)+O2(g)==SO2(g) △H2 ΔH1 ΔH2
(3)已知:高温下,在密闭容器中用H2还原WO2可得到金属钨。当温度过高时,WO2(s)会转变为WO2 (g)。请根据以下反应:
⑤WO2 (s) + 2H2 (g)  W (s) + 2H2O (g) ΔH = +66.0 kJ· mol-1
W (s) + 2H2O (g) ΔH = +66.0 kJ· mol-1
⑥WO2 (g) + 2H2 W (s) + 2H2O (g) ΔH = -137.9 kJ· mol-1
W (s) + 2H2O (g) ΔH = -137.9 kJ· mol-1
计算出WO2 (s)  WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| W |
X |
Y |
Z |
|
| 结构 或性质 |
最高价氧化物对应的水 化物与其气态氢化物反 应得到离子化合物 |
焰色反应呈黄色 |
在同周期主族元素形成的简单离子中,离子半径最小 |
最高正价与最 低负价之和为6 |
(1)W元素和氢可形成离子化合物,其电子式为 。
(2)Y元素和Z元素可形成YZ3化合物,可用于净水剂,净水原理 (用离子方程式表示)。
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号)。
a.最高价氧化物的水化物的碱性 b.相应硫酸盐水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②由X、Y、氢、氧四种元素所组成的化合物,能与盐酸以1:4反应生成两种常见盐和水,则该化合物的化学式为 。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,混合后溶液中离子浓度由大到小的顺序是 。
(1)有以下八种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(ClO)2;④CaCl2;⑤Na2CO3;
⑥NaAlO2;⑦NH3和NaCl;⑧Na2SiO3。向其中分别持续通入CO2,最终能得到沉淀或析出晶体的__ 。
(2)根据下列描述写出下列化学方程式:
①已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的离子方程式: 。
②联氨(N2H4)是航天飞船常用的高能燃料。联氨可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素【CO(NH2)2】和次氯酸钠、氢氧化钠溶液反应生成联氨、碳酸钠、另一种钠盐和水,写出其反应的化学方程式: 。
净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净[Cl2Na(NCO)3,氯元素为+1价]先与水反应,生成次氯酸(HClO)起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸)除去。
(1)优氯净中氮元素的化合价为 。
(2)亚硫酸钠将水中多余次氯酸除去的离子反应方程式为 。
(3)亚硫酸钠溶液在空气中易变质,请写出检验亚硫酸钠溶液是否变质的方法 。
(6分)已知反应:① 2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O;② Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4;
③[ ]K2Cr2O7+[ ]FeSO4+[ ] H2SO4 =[ ]Fe2(SO4)3+[ ]Cr2(SO4)3+[ ]K2SO4+[ ]H2O
(1)上述三个反应中,属于氧化还原反应的是 (填序号);
(2)配平反应③的化学方程式 ;
(3)K2Cr2O7、I2、Fe3+三种微粒氧化性由强到弱的顺序: 。
(15分) 为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。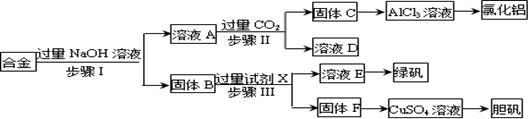
请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤、Ⅲ中均需进行的实验操作是 。
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。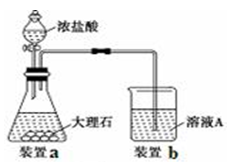
(4)用固体F制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式 ,
请选出你认为的最佳途径 说明选择的理由 。