(15分) 为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
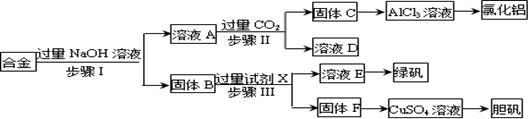
请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤、Ⅲ中均需进行的实验操作是 。
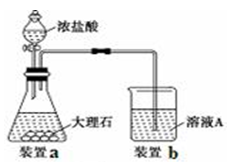
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式 ,
请选出你认为的最佳途径 说明选择的理由 。
(16分)(1)已知:
Fe(s)+1/2O2(g)=FeO(s)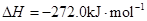
2Al(s)+3/2O2(g)= Al2O3(s)
Al和FeO发生铝热反应的热化学方程式是_____________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如下图所示。
①据图判断该反应是_____(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率___ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用了催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)  Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性____________
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为。(填序号)
a..NH4HCO3 b.NH4Ac.(NH4)2CO3 d.NH4Cl
X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)L的元素符号为___________;M在元素周期表中的位置为____________________。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是__________________________(写化学式)。
(3)原子序数比Y多2的元素的一种 氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是____________________。
氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是____________________。
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是___________________。
(6)碘是人体必需的微量元素之一,有“智力元素”之称。我国从1989年开始,逐步以KIO3取代KI加工碘盐。已知在酸性溶液中可发生反应: IO3-+ 5I-+ 6H+ ="=" 3 I2 + 3 H 22O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在IO3-。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉 试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是_________(填序号)。
试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是_________(填序号)。
下图所示物质(部分产物和反应条件未标出)中,只有A是单质,常温下B是导致酸雨的大气污染物,W是淡黄色固体。
据此回答下列问题:
(1)物质W中所含有的化学键类型为,其阴 、阳离子个数比为。
、阳离子个数比为。
(2)物质C的结构式为。
(3)上图反应中不属于氧化还原反应的有(填写序号)。
(4)写出A和X反应的化学方程式;若生成的B在标准状况下的体积为22.4L,则反应中转移电子数目为。
(5)请写出C和W反应的化学方程式:。
(6)请写出X和 Y反应的离子方程式:。
在 2Na2O2+2CO2===2Na2CO3+O2反应中,
(1)请在此方程上用双线桥法标出电子转移的方向和数目。
(2)是还原剂,是氧化剂。
(3)若转移3mol电子,则所产生的O2在标准状况下的体积为____。
下列物质中:①NaCl ②Na2O ③CH3COOH ④CO2 ⑤NaHCO3 ⑥NH3·H2O ⑦Fe ⑧金刚石 ⑨Cl2 ⑩澄清石灰水 ⑪NaOH, 其中属于电解质的有 ;属于非电解质的有: ;能导电的有:(填序号)