净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净[Cl2Na(NCO)3,氯元素为+1价]先与水反应,生成次氯酸(HClO)起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸)除去。
(1)优氯净中氮元素的化合价为 。
(2)亚硫酸钠将水中多余次氯酸除去的离子反应方程式为 。
(3)亚硫酸钠溶液在空气中易变质,请写出检验亚硫酸钠溶液是否变质的方法 。
(1)对于下列反应:2SO2 + O2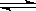 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
(2)下图表示在密闭容器中反应:2SO2+O2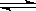 2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是;b c过程中改变的条件可能是;若增
2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是;b c过程中改变的条件可能是;若增 大压强时,反应速度变化情况画在c~d处.
大压强时,反应速度变化情况画在c~d处. 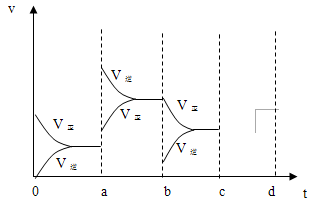
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸:
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反 应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水 时放出的热量是kJ。
时放出的热量是kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点
是
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:
SO2(g)+1/2O2(g)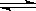 SO3
SO3 (g)△H=-98 kJ·mol-1。
(g)△H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充 入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)v(逆)(填“<”、“>”或“=”)。
入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的
是(填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为;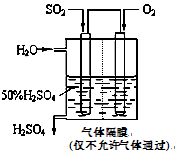
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________。
甲、乙、丙三种物质都含有A元素,只有甲是单质,其转化关系如下:
(1)若乙是目前世界倡导需减少排放的温室气体,丁也含有A元素。则含有7个中子的核素A可用符号表示为,丁溶液呈碱性的原因用离子方程式表示为;已知:在常温常压下,1mol甲和一氧化碳分别与充足的氧气反应放出的热量分别是393.5kJ、283.0kJ。试写出甲与乙相互反应的热化学方程式______________。
(2)若A是非金属元素,其次外层电子是最外层电子数的2倍,则乙在现代通讯中可用于制造,写出一个有丙参加的、能证明碳的非金属性强于A的化学方程式;
(3)若甲是生活中最 常用的过渡金属单质,其在点燃条件与氧气反应生成乙。若丁是稀盐酸,则乙→丙的化学方程式为。
常用的过渡金属单质,其在点燃条件与氧气反应生成乙。若丁是稀盐酸,则乙→丙的化学方程式为。
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2  6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
(4)钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。