利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:
SO2(g)+1/2O2(g)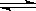 SO3
SO3 (g)△H=-98 kJ·mol-1。
(g)△H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充 入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”)。
入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的
是 (填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为 ;
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________ 。
短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: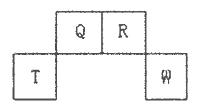
(l)W在周期表中的位置是___________,Q、R、T三种元素原予的半径从大到小排列顺序为(用元素符号表示),Q的最高价氧化物的电子式___________,R气态氢化物分子的结构式为___________;
(2)元素的原子得电子能力:Q_____W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点___________(填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是___________(填名称);
(5)现有8种属于短周期的元素,它们的性质、数据如下表所列。请指出R元素在下表中的对应编号___________,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号___________。
活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1-100纳米。某化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下: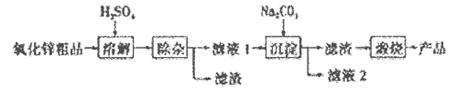
(1)通过__________(填操作名称)可以检验流程中滤液2中含有Na+。
(2)若上述流程图中Na2CO3溶液的pH=12,下列说法正确的是___________。
A该溶液中
B.该溶液中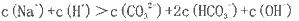
C.该溶液中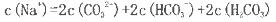
D.若将该溶液稀释至100倍,则pH=10。
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质。取0.5L该溶液先加入___________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0 009 mol/L,则该溶液中至少应加入_______molKMnO4 .
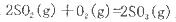 反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的
反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的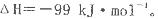 。请回答下问题;
。请回答下问题;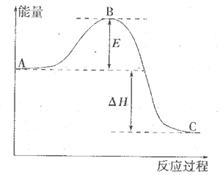
(1)E表示___________________;E的大小对该反应的反应热__________(填“有”或“无”)影响。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中△H___________(填“变大”、“变小”或“不变”),理由是________。
(3)已知单质硫的燃烧热为296 kJ·mol ,计算由S(s)生成2mol SO3(g)的△H =________________。
,计算由S(s)生成2mol SO3(g)的△H =________________。
(4)在一定条件下向容积为2L的容器中通入4molSO2和3molO2,充分反应达平衡后,SO3的体积分数为1/3。若在相同的条件下向容积为2L的容器中通入amolSO2和,bmolSO3,和cmol,反应向逆反应方向进行且达到平衡时SO3的体积分数也为1/3。则c的取值范围为___________。
【物质结构与性质】
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有_______种;
写出Cu+的核外电子排布式_________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有___________种,属于d区的元素有________种。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________;CaO的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是________。
(4)由叠氮化钾(KN3)热分解可得纯 ,下列有关说法正确的是________(填选项字母)。
,下列有关说法正确的是________(填选项字母)。
| A.NaN3与KN3结构类似,前者晶格能较小 |
B.晶体钾的晶胞结构如右图所示,每个晶胞中分摊2个钾原子 |
| C.氮的第一电离能大于氧 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为________,CNO-的中心原子的杂化方式为____________。
(6)在CrCl3溶液中,一定条件下存在组成为 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
将含0.0015mol 的溶液,与R-H完全交换后,中和生成的需浓度为
的溶液,与R-H完全交换后,中和生成的需浓度为
0.1200 mol/LNaOH溶液25.00 mL,则该配离子的化学式为____________。
【有机化学基础】
白酒产品中的塑化剂主要源于塑料接酒桶、塑料输酒管、成品酒塑料内盖等。DBP是塑化剂的一种,可由下列路线合成:
已知以下信息:
(1)A的结构简式是________,D的结构简式是________,D→E的反应类型是________。
(2)D和H2l:l反应生成E,则E官能团名称为________,DBP的分子式为________。
(3)由B和E以物质的量比1:2合成DBP的化学方程式为____________。
(4)写出同时符合下列条件的B的所有同分异构体的结构简式____________。
①能和NaHCO3溶液反应生成CO2③能使FeCl3溶液发生显色反应
②能发生银镜反应④苯环上含碳基团处于对位
(5)写出B与碳酸氢钠溶液反应的化学方程式________。
写出C生成D的反应的化学方程式________。