(1)对于下列反应:2SO2 + O2 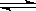 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
(2)下图表示在密闭容器中反应:2SO2+O2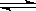 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ;若增
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ;若增 大压强时,反应速度变化情况画在c~d处.
大压强时,反应速度变化情况画在c~d处. 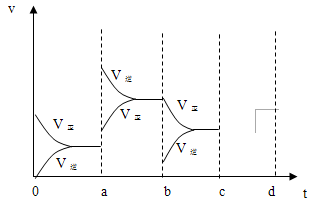
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸:
(共9分)
(1)0.5 mol H2O的质量为 g,其中含有个水分子,共有个原子。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 _ ,在相同温度和相同压强条件下,体积最大的是,体积最小的是。
(3)配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4g;需要CuSO4·5H2O _g。
(4)中和相同体积、相同物质的量浓度的NaOH溶液,并使其生成正盐,需要相同物质的量浓度的HCl、H2SO4、H3PO4溶液的体积比为。
(共5分)用于提纯或分离物质的方法有:
| A.萃取分液 | B.加热分解 | C.蒸发结晶 | D.分液 E、蒸馏 F、过滤、G渗析等,请将提纯或分离的序号填在后面横线上。 |
(1)分离饱和食盐水与泥沙的混合物 _____
_____
(2)分离水和汽油的混合物 _____
(3)海水淡化 ______
(4)从碘水里提取碘 ______
(5)除去氢氧化铁胶体中混有的氯离子、钠离子 ______
______
(共6分) 现有①二氧化硫②蔗糖(C12H22O11)③纯碱 ④铜 ⑤碘的酒精溶液⑥液溴 ⑦石墨 ⑧熟石灰⑨硫酸铝溶液⑩烧碱十种物质,若根据物质的组成或性质进行分类,则(填对应的编号) 下列各组物质中:
⑴属于“混合物”的是_______________⑵能“导电”的是_________
⑶属于“非金属单质”的是___________⑷属于“电解质”的是___________
⑸属于“非电解质”的是⑹属于“碱类物质”的是
根据图示填空
(1)化合物A中含氧官能团的名称是。
(2)1mol A与2 mol H2反应生成1 mol E,其反应方程式是
___________________________________________________。
(3)B在酸性条件下与Br2反应得到D,D的结构简式是 。写出D与NaOH溶液反应的化学方程式_________________________________________。
。写出D与NaOH溶液反应的化学方程式_________________________________________。
(4)F的结构简式是。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为:。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g。 |
(2)A的分子式 为:。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团:。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有种氢原子。 |
| (5)综上所述,A的结构简式。 |