无水氯化铝是一种重要的化工原料,利用明矾石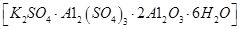 制备无水氯化铝的流程如下:
制备无水氯化铝的流程如下: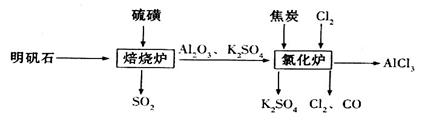
(1)验证焙烧炉产生的气体含有SO2的方法是________________________________。
(2)吸收焙烧炉中产生的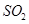 ,下列装置合理的是________(填代号)。
,下列装置合理的是________(填代号)。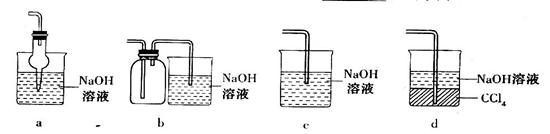
(3)氯化炉中发生反应的化学方程式为_________________________________________。
(4)生产氯化铝的过程中产生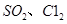 等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)____________。
等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)____________。
仪器自选;可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某学习小组设计用如下装置验证二氧化硫的某些化学性质。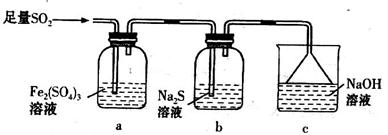
①能说明二氧化硫具有氧化性的实验现象为_____________________________________。
②写出a瓶中发生反应的离子方程式___________________________________________。
③充分反应后,取a瓶中的溶液分成三份,分别进行如下实验。
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去
实验III:向第三份溶液中加入BaC12溶液,生成白色沉淀
上述实验中能证明二氧化硫具有还原性的是________(填实验代号)。
工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3 b.MnO2c.K2Cr2O7
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3可制得重要的催化剂MnO2,MnCO3 → MnO2 + CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是kg。(摩尔质量/g· :MnCO3 115 MnO2 87 MnO 71)
:MnCO3 115 MnO2 87 MnO 71)
下列装置不能完成的实验是
| A |
B |
C |
D |
|||||||||
| 装置 |
|
 |
 |
|
||||||||
| 实验 |
结合秒表测量锌与硫酸的反应速率 |
验证温度对化学平衡的影响 |
验证化学能转化为电能 |
铁的析氢腐蚀实验 |
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。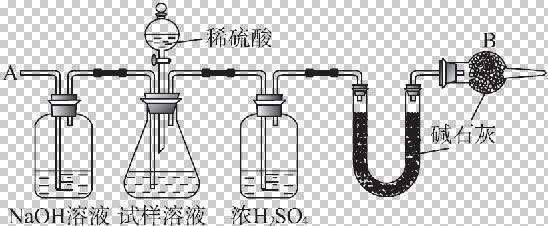
主要实验步骤如下:
①按图组装仪器,并检验装置的气密性。
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液。
③称量盛有碱石灰的U形管的质量,得到b g。
④从分液漏斗滴入一定浓度的稀硫酸,直到不再产生气体时为止。
⑤从导管A处缓缓鼓入一定量的空气。
⑥再次称量盛有碱石灰的U形管的质量,得到c g。
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g。
请填空和完成问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明___________________。
(2)装置中干燥管B的作用是__________________________________。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_______________(填“偏高”“偏低”或“不变”)。
(4)步骤⑤的目的是__________________________________________。
(5)步骤⑦的目的是__________________________________________。
(6)该试样中纯碱的质量分数的计算式为___________________________。
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
有二氧化碳参加或有二氧化碳生成的反应有下列几种情况:
(1)锥形瓶配有主导管的单孔塞,玻璃导管与大气相通,在瓶内玻璃管末端扎紧一个小气球如右图所示。锥形瓶内收集满二氧化碳,迅速投入下列物质,立即塞紧,振荡,一段时间后,气球会自动膨胀的是()
| A.Na2O | B.Na2O2 | C.NaHCO3 | D.NaOH |
(2)另取一个锥形瓶,配有双孔塞,一孔插入玻璃管,玻璃管与大气相通,瓶内玻璃管末端扎紧一个小气球;另一孔插入盛有浓氢氧化钠溶液的滴管,瓶内收集满二氧化碳,塞紧瓶塞。将此瓶放在托盘天平的左盘上,调节天平使之平衡。从天平上取下,挤压滴管使浓氢氧化钠溶液滴入瓶中,振荡,一段时间后再放回托盘天平的左盘上,天平指针________。(填“左偏”“右偏”或“不偏”,下同)
(3)再取一个锥形瓶,配有双孔塞,一孔插入玻璃管,玻璃管的瓶外一端扎紧一个小气球,另一孔插入盛浓盐酸的滴管,瓶内盛碳酸钙粉末和适量水。塞紧瓶塞,将此瓶放在托盘天平的左盘上,调节天平使之平衡。从天平上取下,挤压滴管使浓盐酸滴入瓶中,振荡,使两者反应完全后再放回托盘天平的左盘上,天平指针________。
由两种盐组成的白色粉末混合物,加热时无气体逸出。其焰色反应呈黄色,透过蓝色钴玻璃可观察到紫色。取此白色粉末加硝酸时,粉末完全溶解,生成的无色无味的气体可使澄清石灰水变浑浊。在上述粉末溶于过量的硝酸后的溶液中加入硝酸银溶液,有白色沉淀生成。试推断该混合物的可能组成,并简要说明理由。