工业废水中常含有一定量的Cr2O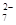 和CrO
和CrO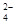 ,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
其中第①步中存在平衡:2CrO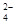 (黄色)+2H+
(黄色)+2H+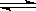 Cr2O
Cr2O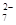 (橙色)+H2O。下列有关说法正确的是
(橙色)+H2O。下列有关说法正确的是
A.第①步当2v(Cr2O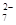 )=v(CrO )=v(CrO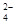 )时,达到了平衡状态 )时,达到了平衡状态 |
B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO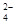 的生成 的生成 |
| C.常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至9 |
D.第②步中,还原0.1 mol Cr2O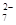 需要91.2 g FeSO4 需要91.2 g FeSO4 |
在密闭容器中,进行如下反应:2A(g)+2B(g)  C(g)+2D(g);ΔH<0,达到平衡后,为提高该反应的速率并使平衡向正反应方向移动,采取的正确措施是()
C(g)+2D(g);ΔH<0,达到平衡后,为提高该反应的速率并使平衡向正反应方向移动,采取的正确措施是()
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入A气体 | D.降低温度同时增大压强 |
已知,NA表示阿伏加德罗常数,下列有关说法正确的是()
| A.11.2L NO气体中含有的原子总数为NA |
| B.1.0L 1.0mol·L-1的NaCl溶液中所含溶质的离子总数为NA |
| C.1mol 氦气体含有的电子总数为4NA |
| D.标准状况下,32gSO2气体所含的原子总数为1.5NA |
溶液中的反应 分别在①、②、③三种不 同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如右图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是
分别在①、②、③三种不 同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如右图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是 
| A.反应进行到5min时实验③的反应速率最快 |
| B.条件②的反应最先达到平衡 |
| C.②与①比较可能是压强更大 |
| D.该反应的正反应是吸热反应 |
绿原酸是咖啡的热水提取液的成分之一,绿原酸结构简式如图,下列关于绿原酸判断不正确的是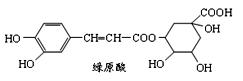
| A.绿原酸既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
| B.绿原酸的官能团中有羧基 |
C.1m ol绿原酸与足量NaOH溶液反应,最多消耗3mol NaOH ol绿原酸与足量NaOH溶液反应,最多消耗3mol NaOH |
| D.绿原酸可以与FeCl3溶液发生显色反应 |
下列溶液中各微粒的浓度关系正确的是
| A.等pH值的氨水、KOH溶液、Ba(OH)2溶液中: c(NH4+)=c(K+)=2c(Ba2+) |
B.0.1 mol/L 的 CH3COONa溶液中:c(CH3COO-) > c(Na+) >c(OH-) >c(H+) CH3COONa溶液中:c(CH3COO-) > c(Na+) >c(OH-) >c(H+) |
| C.常温时向NH4HSO4溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)= c(SO42-) |
| D.将10 mL 0.1 mol/L Na2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中: |
c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)