化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。[已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O]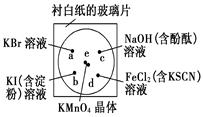
(1)e处反应的离子方程式为________________________________________________。
该反应中发生反应的氧化剂和还原剂的物质的量之比为________。
(2)b处的实验现象为_____________________________________________,
d处的实验现象为_________________________________________________________。
(3)c处反应的化学方程式为___________________________ _____________________。
标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为________mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?________(填“能”或“不能”),若能,其氧化性由强到弱的顺序是________。
若ag CO2含b个原子,则阿伏加德罗常数的值为______________
等质量的O2和O3所含的分子数之比为____________, 所含原子数之比是_______________.
乙醛的化学性质与甲醛相似,试写出有关乙醛的化学反应方程式,并注明反应类型。
(1) 乙醛与氢气在镍作催化剂,加热条件下的反应
_________________________________________________,________________
(2) 乙醛与新制氢氧化铜悬浊液加热条件下的反应
_______________________________________________,_________________;
(3) 乙醛蒸气在足量氧气中充分燃烧
_______________________________________________,_________________。
A的水溶液可用来浸制生物标本,如果乙醇中含B,饮用后会使人眼睛失明,甚至死亡,D是一种有香味的物质。下面是A、B、C、D 相互转化的关系图,请回答下列各题: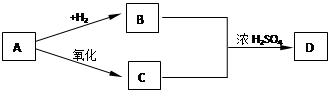
(1)请写出A、B、C、D的结构简式
A____________,B____________,C__________,D____________。
(2)A→B的化学方程式__________________________________,反应类型__________
(3)A→C的化学方程式__________________________________,反应类型__________
(4)生成D的化学方程式________________________________,D的名称_____________
(5)上述物质中能发生银镜反应的有____________,________________,________________。
【选修3:物质结构与性质】
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的价电子(外围电子)排布式为 ;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 ;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。如①CH2=CH2、②HC≡CH、③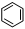 、④HCHO其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
、④HCHO其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 ;