下列关于实验操作的说法正确的是 ( )
| A.可用25 mL碱式滴定管量取20.00 mL KMnO4溶液 |
| B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 |
| C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干 |
| D.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 |
下列实验操作正确的是
| A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 |
| B.收集NO时采用向上排空气法 |
| C.不慎将浓硝酸沾在皮肤上,立即用大量水冲洗 |
D.检验某溶液是否含 时,取少量该溶液,依次加入BaCl2溶液和稀盐酸 时,取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
“封管实验”具有简易、方便、节约、绿色等优点。观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是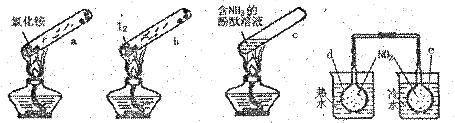
| A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色固体 |
| C.加热时,c中溶液红色变深,冷却后又变浅 |
| D.水浴时,d内气体颜色变浅,e内气体颜色加深 |
下列离子组能在溶液中大量共存的是
| A.Fe2+、H +、Na+、NO3- | B.SiO32-、K+、Br-、H + |
| C.NH4+、Cl-、Mg2+、SO42- | D.Na +、OH-、NH4+、I- |
对下列反应的产物描述正确的是
| A.Fe在氯气中燃烧生成FeCl2 |
| B.将SO2通入BaCl2溶液可生成BaSO3沉淀 |
| C.将CO2通入次氯酸钙溶液可生成次氯酸 |
| D.将Al投入冷的浓硝酸中立即产生大量NO2气体 |
下列说法正确的是
| A.原子核外的电子总是尽先排布在能量最高的电子层里 |
| B.35Cl和37Cl互为同素异形体 |
| C.Al2O3和HNO3都是氧化物 |
| D.氨水的浓度越大,其密度越小 |