某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)检验吸收液中的SO42–: ,则证明Fe3+能把H2SO3氧化为SO42–。
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+ ==2FeCl2+H2SO4+2HCl,反应中的氧化产物是 (写化学式)。
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3(二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红稀溶液。
L-1KSCN溶液、品红稀溶液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 |
若出现血红色,则假设1成立;若未出现血红色,则假设2或假设3成立。 |
| 步骤2: |
结合步骤1的现象和结论, |
某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题: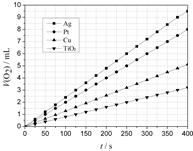
(1)已知:2H2O2(aq) =" 2" H2O (l) + O2(g) 的 < 0, 则该反应的逆反应能否自发进行?(填“能”或“不能”),判断依据是。
< 0, 则该反应的逆反应能否自发进行?(填“能”或“不能”),判断依据是。
(2)某同学选用Ag、Pt、Cu、TiO2作为催化剂,在25℃ 时,保持其它实验条件相同,测得生成的O2体积(V)。V与分解时间(t)的关系如图所示(O2的体积已折算成标准状况),则:在不同催化剂存在下,H2O2分解反应的活化能大小顺序是 Ea( ) > Ea( ) > Ea( ) > Ea( ) (括号内填写催化剂的化学式)金属Pt 催化下,H2O2分解的反应速率v(O2) =mol·s-1
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度T,重复上述实验。获得V(O2) ~ T关系曲线。下列趋势图最可能符合实测V(O2) ~ T关系曲线的是,原因是。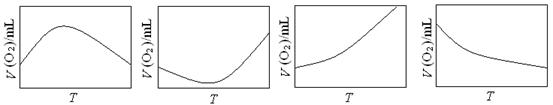
| A. | B. | C. | D. (4)以Pt为电极电解H2O2也可产生氧气,写出H2O2水溶液电解过程中的电极反应式(已知:H2O2的氧化性及还原性均比H2O强):阴极;阳极 。 |
某研究小组以CaCl2和H2为原料,试图制备 +1价Ca的化合物,结果发现产物中只有两种化合物(甲和乙)。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性。请回答下列问题:
(1)该研究小组是否成功制得 +1价Ca的化合物?(填“是”或“否”)。甲的化学式是。
(2)甲与水反应可得H2,其化学方程式是。反应所得溶液经结晶后,可得到一种晶体,其化学式为CaCl2· xCa(OH)2· 12H2O。为确定x的值,请设计实验方案。
(3)在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是。
(4)请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料)。
芳香化合物A(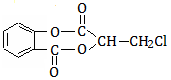 )在一定条件下可以发生如下图所示的转化(其他产物和水已略去)。
)在一定条件下可以发生如下图所示的转化(其他产物和水已略去)。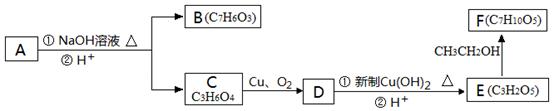
请回答下列问题:
(1)请写出A的分子式。
(2)1molA在氢氧化钠溶液中加热,充分反应消耗氢氧化钠mol。
(3)有机物C可以由乳酸(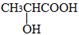 )经过几步有机反应制得,其中最佳的次序是:。
)经过几步有机反应制得,其中最佳的次序是:。
a.消去、加成、水解、酸化 b.氧化、加成、水解、酸化
c.取代、水解、氧化、酸化 d.消去、加成、水解、氧化
(4)写出由E制得F的化学方程式:,反应类型是。
(5)有机物B与乙酸酐(CH3COOCOCH3)直接反应制得阿司匹林(即乙酰水杨酸,分子式C9H8O4),满足以下条件的阿司匹林的同分异构体有种,写出其中任意两种的结构简式:、
。
①苯环上只含有两个侧链②有两个酯基③能发生银镜反应
已知A、B、C、D、E、F六种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
| 元素 |
性质或结构信息 |
| A |
单质常温下为固体,难溶于水易于溶CS2。能形成2种二元含氧酸。 |
| B |
原子的M层有1个未成对的p电子。核外p电子总数大于7。 |
| C |
单质曾被称为“银色的金子”。与锂形成的合金常用于航天飞行器。单质能溶强酸和强碱。 |
| D |
原子核外电子层上s电子总数比p电子总数少2个。单质和氧化物均为空间网状晶体,具有很高的熔、沸点。 |
| E |
其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高。 |
| F |
周期表中电负性最大的元素 |
(1)A原子的最外层电子排布式 ,D原子共有 种不同运动状态的电子。
(2)F与E元素第一电离能的大小关系: > (填元素符号)。
(3)A,B两元素的氢化物分子中键能较小的是 ;分子较稳定的是 。(填分子式)
(4)C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为_________________。
(5)F与钙可组成离子化合物,其晶胞结构如图所示,该化合物的电子式是 。已知该化合物晶胞1/8的体积为2.0×10-23cm3,求该离子化合物的密度,请列式并计算(结果保留一位小数):_______________________。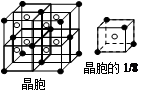
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为和。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为,
第二步反应的离子方程式为。
(3)工业煤干馏得到的产品有焦炭、、等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:__________________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:______________________________。
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是___________________________________________________。
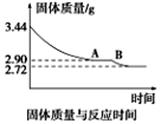
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。