工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O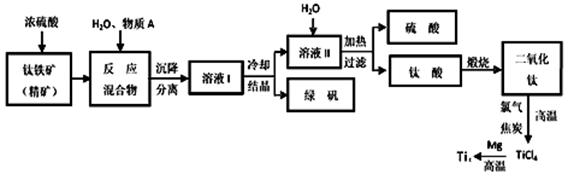
回答下列问题:
(1)钛铁矿和浓硫酸反应属于_________(选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是__________、___________。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_____________________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g)
ΔH1 = -72 kJ•mol-1TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g)
ΔH2 =+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g) ΔH3 =+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行
的原因是______________________。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______________。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO
作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。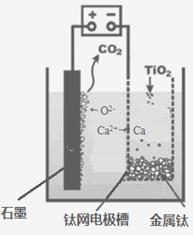
①写出阳极所发生反应的电极反应式:_______________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释) _________。
高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
⑴工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品,,搅拌。
②。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3,,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
⑵Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)。
硫酸锌被广泛应用于工农业生产和医药领域。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下: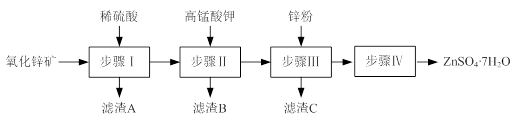
⑴步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是。
②过滤时,为防止堵塞,过滤装置需经常用氢氧化钠溶液清洗,其清洗原理是
(用化学方程式表示)。
⑵步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为。
⑶步骤Ⅲ所得滤渣C的主要成分是。
⑷取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是。
②680 ℃时所得固体的化学式为。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2·6C2H5OH。有关的有机试剂的沸点如下:CH3COOC2H5为77.1℃;C2H5OH为78.3℃;C2H5OC2H5(乙醚)为34.5℃;CH3COOH为118℃。实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇与少量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏。由上面的实验可得到含有乙醇、乙醚、醋酸和水的乙酸乙酯粗产品。
(1)反应中加入的乙醇是过量的,其目的是。
(2)边滴加醋酸,边加热蒸馏的目的是。
将粗产品再经下列步骤精制:
(3)为除去其中的醋酸,可向产品中加入(填字母)。
A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠
(4)再向其中加入饱和氯化钙溶液,振荡,分离,其目的是。
(5)然后再向其中加入无水硫酸铜,振荡,其目的是。最后,将经过上述处理后的液体加入另一干燥的蒸馏瓶内,再蒸馏,弃去低沸点馏分,收集沸点在76℃~78℃之间的馏分即得纯净的乙酸乙酯。
实验室制取的乙烯常含有少量二氧化硫,现设计如下实验,确认混合气体中有乙烯和二氧化硫。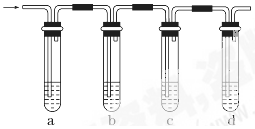
(1)a、b、c、d装置可盛放的试剂是:a________,b______,c_____,d______。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性高锰酸钾溶液 |
(2)确定含有乙烯的现象是_________________________________________________。
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:2 NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0 
(1)实验室制备NH3的化学方程式是:。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是。液体石蜡鼓泡瓶的作用是。
②从反应后的混合物中分离出产品的实验方法是(填写操作名称)。为了得到干燥产品,应采取的方法是(填写选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 真空40 ℃以下烘干
③尾气处理装置如右图所示。双通玻璃管的作用:;
浓硫酸的作用: 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7825 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为。