已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液
(2)各取5mL上述溶液,分别加热(温度相同),pH较小的是________溶液
(3)H2SO4溶液和NH4Cl溶液中由水电离出的c(H+)之比为__________
(4)取5mL NH4Cl溶液,加水稀释至50mL,c(H+) ____________ 10-6mol·L-1(填“>”、“<”或“=”),
c(NH4+)/c(H+)_______________(填“增大”、“减小”或“不变”)
硫及其部分化合物的转化关系如下图所示。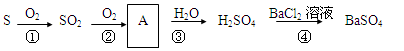
(1)SO2可以使品红溶液褪色,说明SO2具有(填“漂白性”或“氧化性”);
(2)化合物A的化学式为;
(3)反应④的离子方程式为。
(4分)我国已对酒驾实行了“醉驾入刑”,酒的主要成分是乙醇。请回答下列问题:
(1)乙醇的官能团是;
(2)使用K2Cr2O7酸性溶液检测酒驾,利用了乙醇的(填“氧化性”或“还原性”)。
现有以下四种物质:
| A.Si | B.FeCl3 | C.NaHCO3 | D.Na2SiO3 |
请根据题意选择恰当的选项用字母代号填空。
(1)可与KSCN溶液反应,溶液变红的是____;
(2)常用于焙制糕点,也可用作抗酸药的是____;
(3)可用于制备硅胶和木材防火剂的是____;
(4)可用于制造计算机芯片的是。
氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式:;不直接用Cl2作漂白剂的原因是(写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是(填字母序号)。
a.臭氧b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是和。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是。
③已知:
2H2O2(l) ===2H2O(l)+O2(g)ΔH1 =-196.46 kJ·mol-1
H2(g)+ O2(g) ="==" H2O(l)ΔH2 =-285.84 kJ·mol-1
O2(g) ="==" H2O(l)ΔH2 =-285.84 kJ·mol-1
Cl2(g)+H2(g) ="==" 2HCl(g)ΔH3 =-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式:。
根据下列各组溶解度曲线图,判断分离提纯方法。
(1)根据图1中Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100 g水),由Na2SO4溶液得到Na2SO4固体的操作为:将溶液升温结晶、、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是。
(2)根据图2所示相关物质的溶解度曲线。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,,干燥。
(3)根据图1中红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲线。从Na2Cr2O7和 Na2SO4的混合溶液中提取红矾钠的操作为:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是;然后将滤液,从而析出红矾钠。