下列关于离子共存的评价及离子方程式书写正确的是
| 选项 |
离子组 |
评价 |
| A |
H+、Mg2+、Br-、NO3- |
能大量共存于同一溶液中,投入少量锌粉后,可放出H2 ,反应的离子方程式为 Zn+ 2H+ = Zn2++ H2↑ |
| B |
NH4+、CO32-、Cl-、Al3+ |
不能大量共存于同一溶液中,因为有沉淀生成 2Al3++3CO32-=Al2(CO3)3↓ |
| C |
ClO-、Na+、K+、HSO3- |
能大量共存于同一溶液中 |
| D |
HCO3-、OH-、Na+、K+ |
不能大量共存于同一溶液中,因为发生如下反应 HCO3-+ OH-= CO32-+ H2O |
下列物质中含氢原子数最多的是
| A.2 mol CH4 | B.3 mol NH3 | C.4 mol H3PO4 | D.5 mol H2 |
如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是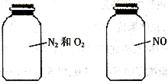
| A.所含原子数相等 | B.气体密度相等 |
| C.气体质量相等 | D.摩尔质量相等 |
下列溶液中,物质的量浓度最大的是
| A.1 L H2SO4溶液中含98 g H2SO4 | B.0.5 L含49 g H2SO4的溶液 |
| C.98 g H2SO4溶于水配成2 L溶液 | D.0.1 L含24.5 g H2SO4的溶液 |
为了除去粗盐中的 Ca2+、Mg2+、SO42-及泥砂,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液⑤加过量 BaCl2溶液
| A.①④②⑤③ | B.④①②⑤③ | C.②④⑤①③ | D.⑤②④①③ |
现有三组溶液:①汽油和氯化钠溶液②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |