下列叙述错误的是
| A.葡萄糖注射液不能产生丁达尔效应,不属于胶体 |
| B.可用蘸浓盐酸的棉棒检验输送氨气的管道是平否漏气 |
| C.明矾和漂白粉常用于自来水的净化和杀菌流消毒,两者原理相同 |
| D.化学变化中一定有能量变化,而有能量变化过程不一定发生化学反应 |
按甲图所示装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是()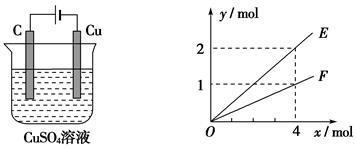
甲乙
| A.E表示生成铜的物质的量 |
| B.E表示总反应中消耗水的物质的量 |
| C.F表示反应生成氧气的物质的量 |
| D.F表示生成硫酸的物质的量 |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)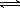 2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是()
2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是()
| A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于()
| A.5% | B.10% | C.15% | D.20% |
可逆反应aA(g)+bB(g)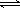 cC(g)+dD(g)符合图所示。则下列叙述正确的是()
cC(g)+dD(g)符合图所示。则下列叙述正确的是()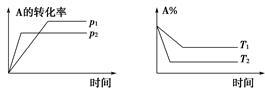
| A.a+b<c+d;正反应吸热 |
| B.a+b>c+d;正反应放热 |
| C.a+b<c+d;正反应放热 |
| D.a+b>c+d;正反应吸热 |
下列热化学方程式或离子方程式中,正确的是()
| A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 |
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1 2NH3(g) ΔH=-38.6 kJ·mol-1 |
| C.氯化镁溶液与氨水反应:Mg2++2OH-===Mg(OH)2↓ |
| D.氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O===2[Al(OH)4]- |