工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3 。其过程如下图所示。
请回答:(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有___________________________________。
(2)将CaO投入含有大量的NH4C1的母液中,能生成可循环使用的NH3,该反应的化学方程式是__________________________________。
(3)向饱和食盐水中首先通入的气体是_______________________,过程III中生成NaHCO3晶体的反应的化学方程式是_________________________________________________________。
(4)碳酸钠晶体失水的能量变化示意图如下:
Na2CO3·H2O(s)脱水反应的热化学方程式是 。
(5)产品纯碱中常含有NaCl。取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体。则该产品中Na2CO3的质量分数是 。
(6)熔融Na2CO3可作甲烷-空气燃料电池的电解质,该电池负极的反应式是_________________。
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:(1)选用的指示剂是。
(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,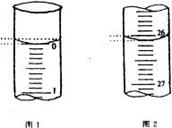
请将数据填入下面表格的空白处。
| 滴定次数 |
待测氢氧化钠溶液的体积/ mL |
0.1000 mol/L 盐酸的体积/ mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/ mL |
||
| 第一次 |
25.00 |
|||
| 第二次 |
25.00 |
2.00 |
28.08 |
26.08 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(5)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(6)滴定终点的判定依据是。
某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示(图中连接胶管、夹持和加热装置省略): 
查阅资料可知,HSO3- 的酸性强弱与H2CO3相近。请回答下列问题:
(1)装置A中发生反应的化学方程式是:A
(2)上述装置的接口连接顺序依次是a→→→→→g→h→d(填导管接口字母)。
(3证明SO2具有氧化性的现象是;证明SO2具有还原性的实验中,反应的离子方程式是。
(4)C试管中NaOH溶液的作用是,CCl4的作用是。
(本小题14分)下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。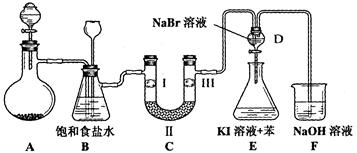
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:________________________。
(2)装置B中饱和食盐水的作用是________________________________________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入__________。
| A |
B |
C |
D |
|
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_______________________________。
(5)某同学建议将装置F中的药品改用足量的NaHSO3溶液吸收余氯,老师认为不妥,用总反应的离子方程式解释原因_____________________________________。
(12分)某化学课外小组为测定空气中CO2的含量,进行了如下实验:
(1)配制0.100 0 mol·L-1和0.010 00 mol·L-1的标准盐酸。
(2)用0.100 0 mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00 mL,结果用去盐酸19.60 mL。
(3)用测定的Ba(OH)2溶液吸收定量空气的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里,加水至刻度线。取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
(4)过滤上述所得浊液。
(5)取滤液20.00 mL,用0.010 00 mol·L-1的盐酸滴定,用去盐酸34.80 mL。请回答下列问题:
①配制标准盐酸时,需用下列哪些仪器________;
| A.托盘天平 |
| B.容量瓶 |
| C.酸式滴定管 |
| D.量筒 |
E.烧杯
F.胶头滴管
G.玻璃棒
②滴定操作中,左手__________,右手__________,眼睛________________________。
③Ba(OH)2溶液的物质的量浓度是________________________________________;
④过滤所得浊液的目的是_________________________________________________;
⑤此空气样品中含CO2的体积分数为______________________________________。
(共18分)如图中,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置。
(1)上述装置中有一处错误,请指出是处(用字母表示)。
(2)通过B是为了除去,在B中应加入;通过C是为了除去。
(3)写出D、F中发生反应的化学方程式、。
(4)如果A中产生氯气3.36L(标准状况),请计算:
①写出A中发生反应的化学方程式,并标出A中的电子转移情况。
②消耗MnO2的物质的量。
③被氧化的HCl的物质的量。