X、Y、Z、W、V是原子序数依次增大的短周期主族元素,其中两种为金属元素。Y的原子半径是短周期主族元素中最大的,Z的单质可与Y的最高价氧化物的水化物溶液反应,X与W同主族,且W的原子序数是X的两倍。请回答下列问题:
(1)W的氢化物的电子式是 ,其相对分子质量与H2O2的相对分子质量相等,但其沸点却低于H2O2的沸点,可能的原因是_________________________;
(2)Z的单质与Y的最高价氧化物的水化物溶液溶液反应的离子方程式是______________;
(3)X与W以原子个数比2∶1形成的化合物能使溴的水溶液褪色,写出反应的离子方程式__________,该化合物表现了 性;
(4)V的单质溶于水后形成的溶液中存在的粒子有 种。
已知有机物中一个碳原子上连有两个羟基时,易脱水形成碳氧双键;物质A→F有如下转化关系:
请回答下列问题:
(1)E中含有的官能团的名称是_____________,C跟新制的氢氧化铜悬浊液反应的化学方程式为:________________________________________________________。
(2)已知B的相对分子质量为162,其燃烧产物中n(CO2):n(H2O)=2:1。则B的分子式为_________________。
(3)F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应。
若F的苯环上的一氯代物只有两种,则F在一定条件下发生加聚反应的化学方程式为:
____________________________________________________________________________。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。则G可能具有______________种结构,写出其中两种的结构简式___________、____________。
(1)用0.1mol/L NaOH溶液分别中和pH和体积均相同的盐酸和醋酸,消耗NaOH溶液的体积较多的是。
(2)已知NaHCO3水溶液呈碱性,则其溶液中五种离子的浓度由大到小的顺序是(用规范的浓度符号回答)。
用规范的化学语言回答下列问题:
(1)过氧化钠跟CO2反应的化学方程式。
(2)一定条件下,乙醛可跟氢气反应生成乙醇,该反应的反应类型是。
(3)氯化铵溶液呈酸性的原因(用离子方程式回答)。
(4)氢氧化镁浊液中的溶解沉淀平衡方程式。
(5)氯碱工业中用电解饱和食盐水的方法制取烧碱和氯气,该电解过程中的电极反应方程式为:阳极,阴极。
稀盐酸与铝发生反应,要生成3.36L氢气(标准状况),需消耗铝g;反应过程中转移mol电子。
电浮选凝聚法是工业上采用的一种污水处理方法下图是电解污水装置示意图。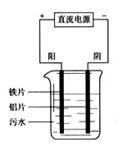
(1)根据污水净化原理写出阳极和阴极的电极反应:
阳极:_____________________,_________________,____________________。
阴极:______________________________。
(2)分析最后底层积聚的一层沉渣是如何沉淀的:__________________________________ __。
(3)一些悬浮物是怎样形成浮渣的:___________________________________________________。