电浮选凝聚法是工业上采用的一种污水处理方法下图是电解污水装置示意图。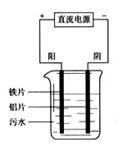
(1)根据污水净化原理写出阳极和阴极的电极反应:
阳极:_____________________,_________________,____________________。
阴极:______________________________。
(2)分析最后底层积聚的一层沉渣是如何沉淀的:__________________________________ __。
(3)一些悬浮物是怎样形成浮渣的:___________________________________________________。
某温度时,在2 L的密闭容器中,M、N两种物质的量随时间的变化曲线如下图所示。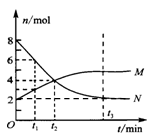
(1)达到平衡时N的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为;
(3)若t2=2,则反应从开始至2分钟末,用M的浓度变化表示的平均反应速率为 v(M)=;
某有机物A经分析,含碳的质量分数为90%,含氢的质量分数为10% 。其蒸气相对于氢气的密度为60,则:
(1)有机物A的分子式为:
(2)经红外光谱测知A为苯的同系物,且核磁共振氢谱峰面积比为3:2:2:2:3,则其结构简式为:
(3)有机物A在一定条件下有下列转化关系:
请回答:
①D中含氧官能团名称:
②B→F的反应类型:,高分子化合物H的结构简式:
③E→G的化学方程式:
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。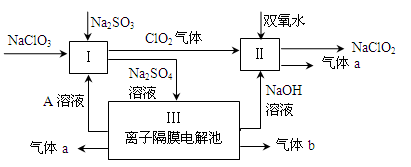
(1)Ⅰ中发生反应的还原剂是(填化学式)。
(2)Ⅱ中反应的离子方程式是。
(3)A的化学式是,气体b的化学式是,装置Ⅲ中发生反应的化学方程式是。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O。
①该反应中氧化剂和还原剂的物质的量之比是。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是。
只用试管和胶头滴管就可以鉴别的下列各组溶液是(填序号)
①AlCl3溶液和NaOH溶液②Ca(HCO3)2溶液和NaOH溶液 ③NaAlO2溶液和盐酸
④Al2(SO4)3溶液和氨水⑤AgNO3溶液和氨水
高锰酸钾和氢溴酸溶液可以发生下列反应 KMnO4 + HBr→ Br2 + MnBr2 + KBr + H2O其中还原剂是;若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是mol。