某学习小组的同学们在做氢氧化钠溶液和稀硫酸的中和反应实验中,突然发现未给烧杯中滴加指示剂。于是将实验改为探究烧杯内的溶液中溶质的成分。
【提出问题】烧杯内的溶液中溶质是什么?
【猜想与假设】同学们经过讨论,一致认为溶质一定有硫酸钠,写出生成硫酸钠的化学方程式
【查阅资料】硫酸钠溶液呈中性。
【设计与实验】(1)同学们取少量烧杯中的溶液于试管中,滴加酚酞溶液,无明显现象产生,据此推断
(2)小丽同学取少量烧杯中的溶液于试管中,滴加氯化钡溶液,有白色沉淀生成,她据此确定溶质还有硫酸。反应的化学方程式为
(3)小华同学提出质疑,因为溶液中的硫酸钠与氯化钡反应也能产生白色沉淀。为了证明溶质是否还有硫酸,请你与同学们一起进行如下探究(要求不能选用指示剂和
试纸)。
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量烧杯中的溶液于试管中,加入 |
|
溶质还有硫酸 |
【反思与评价】(1)在探究化学反应后的剩余物质的成分是,除了考虑生成物,还要考虑
(2)复分解反应发生的条件是
某化学研究性学习小组进行了氨(
)的制取和有关性质的探究实验。
资料卡片:氨气通常情况下是有刺激性气味的无色气体,密度比空气小,能使湿润的红色石蕊试纸变蓝色,极易溶于水,浓氨水具有挥发性。加热熟石灰和氯化铵固体混合物可以生成氨气,若要快速产生氨气,可以将浓氨水滴加到生石灰中得到。
请根据有关信息回答下列问题:
(1)仪器a的名称是。
(2)利用A装置制取氨气的化学方程式是。
(3)将浓氨水滴加到生石灰中快速产生氨气,发生装置最好是(选填装置编号)。
(4)研究性学习小组用D装置收集氨气,判断氨气已经收集满的方法是。
(5)研究性学习小组用下图所示的装置探究氨的性质,观察到脱脂棉团由白色变为红色。该现象涉及到的性质是(填字母编号)。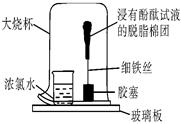
| A. |
氨分子是不断运动的 |
B. |
浓氨水具有挥发性 |
C. |
氨气有刺激性气味 |
D. |
氨气的水溶液显碱性 |
(6)若将制取氨气的熟石灰溶于水形成的饱和溶液置于小烧杯并放入一只大烧杯中(如下图),在大烧杯中加入下列物质,观察到小烧杯中饱和溶液变浑浊,则加入的物质是(填字母编号)。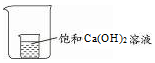
| A. |
水和浓硫酸 |
B. |
水和氯化钠固体 |
C. |
水和硝酸铵固体 |
D. |
水和氢氧化钠固体 |
实验室可利用碱式碳酸铜(化学式:
)制备氧化铜,并进行碳粉还原氧化铜的实验。
①制备氧化铜并检验产物,装置如下图所示(省略夹持仪器):
步骤一:连接
和
,打开活塞,通入空气。
步骤二:关闭活塞,连上
和
,开始加热。
步骤三:在加热过程中,记录在
中固体质量变化如下表,在
时停止加热。
| 加热时间(
) |
0 |
|||
|
中固体质量(
) |
6.66 |
5.20 |
4.80 |
4.80 |
中发生反应的化学方程式为
→
+
+
↑
请在中填入配平后的系数。
中试剂是。
的作用是吸收空气中的,防止对产物检验造成干扰。选择
时停止加热的理由是。
一定量碳粉还原①中制得的氧化铜并检验产物,装置如下图所示:
实验过程中,观察到
中溶液变浑浊,
中的现象是。
反应完全后,若仅撤走酒精喷灯停止加热,可能导致的后果是。
分析:若①中省略步骤三,对②中反应产物判断可能产生的影响及其原因。
科学家设想利用太阳能加热器"捕捉
"、"释放
",实现碳循环(如图所示)。
某化学小组的同学对此非常感兴趣,在老师的指导下,设计如下装置探究上述设想的反应原理是否可行。
(1)能证明装置
"释放
"的现象是;
(2)装置
在实验结束撤掉酒精喷灯时的作用是;
(3)上述反应结束后,小组同学对
中固体的成分进行探究,以证明是否"捕捉"到
。
【猜想与假设】
中的固体可能为:I.只有氧化钙;Ⅱ.氧化钙与碳酸钙;Ⅲ.只有碳酸钙
【进行实验】
①甲同学从
中取一定量的固体于试管中,并加入一定量的水,振荡,有白色不溶物。甲同学据此认为试管中的固体为碳酸钙,即猜想Ⅲ成立。乙同学认为上述实验不足以证明猜想Ⅲ成立,其理由是。
②乙同学从
中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热;继续向试管中加入几滴稀盐酸,没有发现气泡产生。乙同学据此认为试管中的固体只有氧化钙,即猜想I成立。丙同学认为乙的实验不足以证明猜想I成立,理由是。
③丙同学认为利用感觉温度变化的方法判断是否有氧化钙不可靠,他用水、酚酞试液和
稀盐酸证明了猜想Ⅱ成立,请完成他的实验报告。
| 实验步骤 |
实验现象 |
实验结论 |
| 猜想Ⅱ成立 |
(4)通过以上探究,小组同学认为科学家的设想在反应原理上是可行的。该设想的优点有(填字母序号)。
| A. |
原料易得 |
B. |
充分利用太阳能 |
C. |
释放出的 可作为资源加以利用 |
实验是科学探究的重要方法。如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题。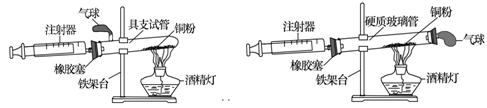
装置一 装置二
(1)根据下表提供的实验数据,完成下表
| 硬质玻璃管中空气的体积 |
反应前注射器中空气体积 |
反应后注射器中气体体积 |
实验测得空气中氧气的体积分数 |
| 25 | 15 | 9 |
(2)装置一和装置二中气球的位置不同,(填"装置一"或"装置二")更合理,理由是。
(3)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条);。
某化学小组查阅资料得知:在不同温度下,甲烷(
)可将氧化铁(
)还原为
、
中的一种可两种。他们为探究甲烷与氧化铁反应后产物(黑色粉末)的成分,进行了如下实验:
(1)按图1装置连接好仪器,检查装置的气密性后,往装置中添加药品。
①各黑色粉末中滴加稀硫酸,观察到有气泡产生,则黑色粉末中含有,产生气泡的化学方程式是。
②导管
的作用是。
(2)按图2装置连接好仪器(图中夹持设备已略去)检查装置的气密性,往装置中添加药品,打开止水夹
通入含有少量二氧化碳的的一氧化碳,持续一段时间后再点燃装置
处的酒精喷灯。
①装置
中反应的化学方程式为,装置
中浓硫酸的作用是。
②持续一段时间后再点燃装置
处的酒精喷灯的原因是。
装置的作用是。
③实验中观察到装置
中石灰水变浑浊,则黑色粉末中含有。尾气处理方法为。