(9分) 2011年5月1日,我国实施“醉驾入刑”的新规,引起西园中学化学探究小组的注意,并设计如图实验,对人酒后呼出的气体与空气组成进行比较(不比较水蒸气).
【查阅资料】重铬酸钾溶液与乙醇反应,溶液由黄色变成浅绿色.
【提出假设】
猜想1:呼出的气体中含有乙醇;
猜想2:呼出的气体中 含量比空气的低;
猜想3:呼出的气体中 含量比空气的高.
【实验方案】
(1)按如图装置取气,得空气、呼出气体样品分别于A、C集气瓶中,取多瓶气样备用.
(2)图中澄清石灰水的作用是 .
(3)请填写空格
| 实验步骤 |
预期现象和结论 |
| ①向C集气瓶中伸入燃着的木条 |
火焰 ,证明猜想 成立 |
| ②同时向A、C集气瓶中加入等量的 |
若C集气瓶中 ,且较明显,证明猜想3成立 |
| ③分别向A、C集气瓶中加入少量重铬酸钾溶液 |
若 ,证明 . |
以下是实验室制取氧气的装置图,请按要求回答下列问题.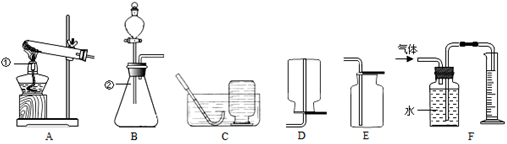
⑴写出图中标号仪器的名称:① 。
⑵实验室用氯酸钾制取并收集一瓶干燥的氧气,应选用的装置组合是 (填字母
序号,下同)。
⑶实验室用H2O2溶液和MnO2混合制氧气,该反应的化学方程式为 。
同学们利用B和F装置,通过排水量来测定生成氧气的体积,反应结束后,发现量筒内
|
收集到的水的体积总是比理论值偏大(水的体积测量准确),其主要原因是 。
⑷若用如图所示医用塑料袋排空气法收集H2,则H2导入端为 (填“a”或“b”)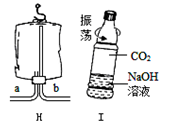
小强学习了金属活动顺序后,觉得非常神奇和有趣,刚好有一次机会到化学实验室做实验,他决定自己做一个探究实验。
(1)他猜想:假如将金属钠放入到硫酸铜溶液中,能不能把铜置换出来呢?
假如他的猜想正确,反应的化学方程式为:,
实验的现象为(写两点)。
(2)进行实验:他将保存在煤油中的金属钠用镊子取出,用滤纸吸干表面的煤油,然后用小刀将金属钠切下绿豆大小的一块放入到装有100mL5%硫酸铜溶液的250mL烧杯中,在烧杯口盖上一块玻璃片,观察到金属钠在溶液表面剧烈反应,四处游动,有“嘶嘶”声,熔化并燃烧,有轻微爆炸声,反应完毕后观察到溶液中有蓝色絮状沉淀和少量黑色固体。
(3)为什么会得到与猜想不同的实验现象呢?小强通过查阅资料知道:金属钠的化学性质非常活泼,能与水反应生成一种可燃性气体和另一种能使无色酚酞变红的物质,同时放出大量的热;氢氧化镁受热时能分解生成两种氧化物,其它难溶的氢氧化物也有类似的化学性质。
(4)分析与小结:小强通过资料并结合实验现象,认为该实验过程中可能发生了三个化学反应,请依次写出反应的化学方程式,,
。
(5)反思与交流:通过(2)可知金属钠有什么物理性质(写出一点即可)?。
金属钠为什么要保存在煤油中(写出一点即可)?。
根据下列装置图填空: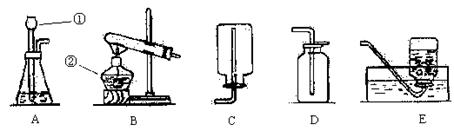
(1)写出编号①、②仪器的名称:①________________;②________________。
(2)实验室制取二氧化碳的发生装置应选用___________(填序号,下同),收集装置应选用___________;若在实验室用加热高锰酸钾的方法制取氧气,反应的化学方程式为___________,如果收集的氧气要用于验证蜡烛燃烧产物的实验,收集装置应选用___________。
我校某班化学兴趣小组为验证鱼骨的成分,把鱼骨放在酒精灯上充分煅烧,得到白色固体,冷却后研成粉末,再向白色粉末中加入足量的稀盐酸,有能使澄清石灰水变浑浊的无色无味气体产生。请回答:
已知动物的骨骼中含有Ca2+,则鱼骨中至少含有的物质是_________(填名称);
下列说法中错误的是()
| A.鱼骨放入稀盐酸中浸泡会变软。 | B.饮用牛奶可补充钙质。 |
| C.骨质疏松患者不宜补钙。 | D.胃酸(中含有盐酸)能促进钙质的吸收。 |
某化学课外活动小组在实验室配制石灰水时,发现烧杯底部仍有固体未溶解,对熟石灰样品的主要成分进行了探究。请你参与讨论并完成实验报告。
【提出问题】针对该熟石灰样品的成分,同学们展开了讨论,小明认为溶解后剩余固体为变质后的难溶性物质,变质的化学方程式为。小华同学不同意他的判断,你认为小华同学的理由是。
【进行猜想】 猜想一:熟石灰样品成分是Ca(OH)2
猜想二:熟石灰样品成分是CaCO3
猜想三:你认为熟石灰样品成分还可能是。
【实验与结论】请你通过实验验证你的猜想:
| 实验步骤 |
实验现象 |
实验结论 |
| 取小烧杯中的物质进行(填操作名称),得到固体和液体。 |
 |
猜想三正确 |
| 向滤液中加入适量溶液; |
溶液变蓝 |
|
| 向固体中加入适量稀盐酸。 |
【拓展与应用】
1.小组同学反思了熟石灰变质的原因,在初中化学我们所学过的物质中还有(举一例)等也具有这样的性质,认识到这两种物质都应保存。
2.小明想测定样品中Ca(OH)2的质量分数,称取上述0.5g样品,加足量水使之充分溶解,搅拌过滤后,在实验室用pH试纸和配制好的10%盐酸溶液进行实验,实验数据记录见下表.
| 加入盐酸溶液的质量/g |
0 |
2 |
3.65 |
6 |
| 样品的pH |
12 |
9 |
7 |
4 |
(1)当pH=4时,溶液中所含的溶质是(写化学式)
(2)求样品中Ca(OH)2的质量分数。