我校某班化学兴趣小组为验证鱼骨的成分,把鱼骨放在酒精灯上充分煅烧,得到白色固体,冷却后研成粉末,再向白色粉末中加入足量的稀盐酸,有能使澄清石灰水变浑浊的无色无味气体产生。请回答:
已知动物的骨骼中含有Ca2+,则鱼骨中至少含有的物质是_________(填名称);
下列说法中错误的是( )
| A.鱼骨放入稀盐酸中浸泡会变软。 | B.饮用牛奶可补充钙质。 |
| C.骨质疏松患者不宜补钙。 | D.胃酸(中含有盐酸)能促进钙质的吸收。 |
【2015年四川省眉山市】某化学兴趣小组进行铁生锈的实验探究活动。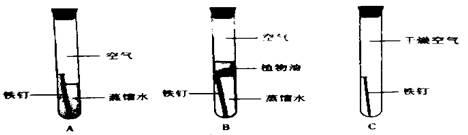
[探究一] 铁生锈的条件
(1)该兴趣小组将洁净无锈的铁钉分别置于上图所示装置中,经过一段时间观察 ,(填装置序号)装置中出现了明显的锈迹。
他们的结论:铁生锈是因为铁与空气中的 等发生了化学反应。
(2)甲同学提出了疑问:空气中的氮气、二氧化碳没有参与铁的生锈过程吗?请设计实验为甲同学释疑。 ,观察并记录现象即可证明。
[探究二] 影响铁生锈速率快慢的因素
乙同学说:妈妈常说菜刀沾有盐水生锈更快。这种说法对吗?同学广泛查阅资料。
资料一:导电性强的溶液都可加速铁的生锈。
资料二:海上航行的轮船在与海水接触的部分镶嵌一锌块,能有效降低钢材被腐蚀的速率。
(3)将上述A装置中的蒸馏水改为下列液体中的 ,可使铁生锈的速率加快。
a.硫酸钠溶液 b.无水乙醇 C.蔗糖溶液
(4)一些铁制品表面覆盖了某些涂层。不同的涂层被破坏后,铁生锈的速率不同。你认为下列 涂层破坏后,铁生锈的速率较快。
a.镀锌铁 b.镀锡铁
(5)一些建筑的大门刷上了一层银白色的金属,你认为该金属可能是 。
a.银粉 b.铜粉 c.镁粉
[交流与思考]
(6)写出一种防止铁生锈的方法 。
【2015年湖北省荆门市】请认真阅读材料,回答下列有关问题。
能源问题是困扰人类可持续发展的一个重要因素。能源的开采、开发、储存和综合利用是目前世界各国科学家研究的重大课题。
(1)人类目前使用的化石燃料有煤、天然气和 。
(2)天然气是常见的燃料,写出其燃烧的化学方程式: 。
(3)我国是世界产煤大国。但含硫煤燃烧排放的二氧化硫,会引起“酸雨”。为减少大气污染,某发电厂采用了“石灰固硫法”,即在一定条件下向煤中掺入生石灰,用来吸收二氧化硫,已知这一过程中,各元素的化合价均未发生改变,写出“石灰固硫法”的化学方程式 。
(4)科学家预言,氢能将成为21世纪的主要能源,试从氢气的性质分析氢气作为能源的主要优点: 。
(5)如图所示是甲、乙两种物质(不含结晶水)的溶解度曲线。
①下列有关说法正确的是()
| A.t2℃时,甲、乙溶液中溶质的质量分数一定相等 |
| B.t1℃时,甲的溶解度为40 |
| C.t3℃时,甲、乙的饱和溶液分别恒温蒸发相同的水,甲析出的晶体的质量比乙多 |
| D.甲的溶解度大于乙的溶解度 |
②将t3℃甲物质的不饱和溶液变成饱和溶液,可采取 方法。
(6)如图所示都是常见的日常生活用品,其中是有机高分子材料的有: (填序号)。生活中要鉴别羊毛衫和合成纤维, 可通过 的方法 。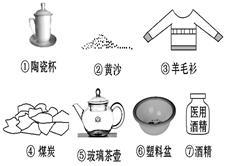
课外小科约老师继续探究铁粉和硫粉反应的实验:他们各自取一定量的铁粉和硫粉均匀混合后堆放在石棉网上,在其中插入烧红的玻璃棒,反应立即发生。拿掉玻璃棒后,反应继续剧烈进行,反应过程中有少量刺激性气味的气体x产生。反应结束后,都得到了黑色固体。老师得到的黑色固体不会被磁铁吸引,而小科的却会被磁铁吸引。
(1)铁和硫的反应是 (填"放热"或"吸热")反应。
(2)气体x的化学式为 。
(3)对比老师的实验结果,小科猜想自己得到的黑色固体可能是有剩余的铁或有生成的四氧化三铁。小科想验证是否有铁剩余。
老师启发小科:硫化亚铁能与稀硫酸反应,产生硫化氢气体,该气体能被氢氧化钠溶液吸收。于是,小科认为正确连接如图所示的三个装置并进行实验,如果a处有水压出,就能验证有铁剩余。 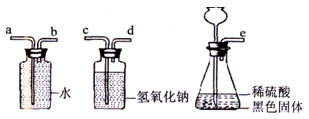
①小科依次连接各装置的导管口:e→→b→a。(填"c→d"或"d→c")
②老师指出设计不够合理,不能就此验正猜想。请你帮小科说出不够合理的原因: 。
于是小科改进了实验设计,继续进行探究…
兴趣小组的同学在做镁条和盐酸反应实验时发现,试管外壁很烫,试管口出现白雾。白雾是什么呢?
Ⅰ.同学们作出猜想
猜想一:是小水滴。因为盐酸溶液中的水受热会汽化上升,在试管口 (填物态变化名称)成小水滴。
猜想二:是盐酸小液滴。因为浓盐酸具有 性,可能实验中使用的盐酸浓度过高,试管口就会形成盐酸小液滴。
同学们将干燥的蓝色石蕊试纸放在内有正在反应的镁条和盐酸的试管口,试纸变红,证明猜想二是合理的。
Ⅱ.小柯提出质疑
为什么刚才打开盛放实验所用盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白雾?
小柯联系反应时试管外壁很烫,于是猜想:白雾的形成可能与温度有关。
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后 (填操作),试纸变红。
得出结论:这种盐酸浓度并不高,是镁和盐酸反应放热促使盐酸形成白雾。
【2015年福建省厦门市】用如图装置完成以下实验:
(1)探究燃烧条件:若B处盛放木炭。
Ⅰ.先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
Ⅱ.待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
Ⅲ.在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊。
Ⅰ与Ⅲ对比,说明燃烧的条件之一是____________;Ⅱ与Ⅲ对比,说明燃烧的条件之一是_____________。
(2)模拟工业炼铁:若B处盛放氧化铁粉末。在A处通入一氧化碳一段时间后,B处下方用喷灯加热,B处可观察到的现象为______________________________,尾气处理的方法为__________________________。《自然》杂志刊载“绿色炼铁”技术;电解熔融的氧化铁得到铁和氧气,该反应的化学方程式:_____________________,该炼铁技术另一种产物的用途为___________________________________。