生石灰常用作食品干燥剂,其包装袋上除了标明主要成分为生石灰外,还提醒人们注意:不可食用,不可浸水,不可开袋,儿童勿碰.
Ⅰ.华雪同学通过探究发现,某食品包装袋中的生石灰干燥剂已经变质失效.他采用的探究方法是:取少量样品于试管中,加入少量水,用手触摸试管外壁,没有明显的放热现象.此实验中加入的水必须是少量的,理由是①
Ⅱ.甲、乙同学想知道刚从食品袋中取出的生石灰干燥剂的成分,进行了如下探究:
【提出问题】
生石灰干燥剂中含有哪些物质
【查阅资料】
工业上用高温煅烧石灰石的方法来制取生石灰.
【猜想与假设】
猜想1:含有氧化钙、氢氧化钙
猜想2:含有氧化钙、碳酸钙
猜想3:含有氧化钙、氢氧化钙、碳酸钙
【活动与探究】
甲、乙同学为了验证猜想,进行了如下实验:
甲同学实验:取少量样品于试管中,加入适量水充分反应后,再滴加几滴无色酚酞溶液,可观察到溶液呈红色.
乙同学实验:取少量样品于试管中,加入足量的稀盐酸,有无色无味的气体产生,该气体能使澄清的石灰水变浑浊.
【结论与反思】
(1)猜想②
(2)甲同学实验中,发生反应的化学方程式是③
(3)乙同学实验中产生气体的化学方程式是⑤
(4)乙同学认为甲同学的实验是多余的,因为⑥
【总结与提升】
(1)甲、乙同学最终无法确定该生石灰干燥剂的成分,实验失败.华雪同学认为,可以通过定量实验来确定.在定量实验时一定要用到的实验操作是⑦
(2)打开食品包装袋后,生石灰干燥剂不宜继续与食品放在一起,因为⑧
(3)请写出工业上制生石灰的化学方程式⑨
小梅同学学习了单质、氧化物、酸、碱、盐性质后,发现许多不同类别的物质反应时能生产盐,于是她构建了下图所示的知识网络图。铜及其化合物在工业上有重要的应用。借助网络图回答: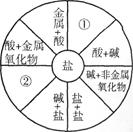
(1)写出用酸和碱生产硫酸铜的化学方程式:
。
(2)请你把图中①②处补充完整,要求不能与图中已有信息重复。
①;②。
(3)根据网络图可制备物质。例如,某回收含铜电缆废料的工厂有下列制铜的方案: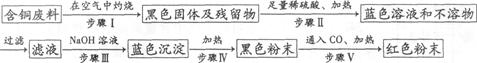
①写出下列步骤中的化学方程式:
步骤Ⅲ:。
步骤V:。。
②上述方案中可能造成空气污染的步骤是 。
某同学做“证明鸡蛋壳的主要成分是碳酸盐,并收集纯净的气体”的实验。设计了如下方案进行实验: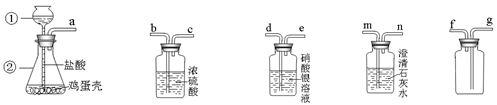
AB C D E
(1)写出所标仪器的名称:①、②。
(2)描述A中发生的现象:。
(3)根据我们所学的知识,你认为A装置和装置相连并产生什么现象时就足以说明鸡蛋壳的主要成分是碳酸盐?;写出该装置中发生反应的化学方程式:。
(4)该同学想要收集一瓶纯净的该气体,进一步验证它的性质。连接上述装置的顺序是:(填写各接口字母)。其中,C装置的作用是:;写出有关反应的化学方程式:。
(5)写出用A装置还可以制取的日常生活中一种常见气体的化学反应方程式:。并说出它的一个重要用途。
水蒸气通过灼热的焦炭后得到的混合气体有哪些成分?某化学兴趣小组在老师的指导下,对此进行了实验探究。
【提出猜想】1.该混合气体只含有一氧化碳、氢气
2.该混合气体含有一氧化碳、二氧化碳、氢气和水蒸气
3.该混合气体只含有二氧化碳、氢气和水蒸气
4.该混合气体只含有一氧化碳、二氧化碳和氢气
【查阅资料】a.无水硫酸铜遇水由白色变为蓝色。
b.碱石灰是固体氢氧化钠和氧化钙的混合物。
c.浓硫酸具有强烈的吸水性,常用作某些气体的干燥剂
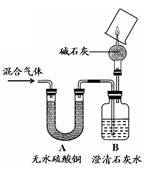
【实验过程】同学们在老师的指导下设计了如下图所示装置,并进行了实验(部分夹持仪器已略去)。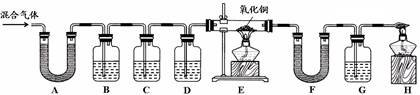
(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有。B中变化的化学方程式为。
(2)装置C中的药品为。
(3)E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,说明混合气体中还存在的气体是; E中的变化说明氧化铜具有性。
【实验结论】猜想正确。
【实验反思】
经过讨论,同学们将上图中装置C~H进行了简化,只用下图所示装置并自选必要试剂就能完成探究。其中,干燥管中碱石灰的作用为,烧杯上能观察到的现象是。最后一步的实验操作及现象是
。
发酵粉是一种制作风味糕点的常见蓬松剂。某兴趣小组拟对其化学成分进行如下探究。
【查阅资料】①发酵粉一般含有NH4HCO3、NaHCO3、明矾[KAl(SO4)2∙12H2O]中的2种。②已知反应:2NaHCO3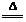 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【提出假设】假设1:有NH4HCO3和NaHCO3;
假设2:有NaHCO3和明矾;
假设3:有和明矾。
【方案与流程】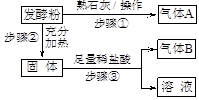
【问题与讨论】
(1)步骤①的操作是在研钵中把发酵粉和熟石灰混合、研磨。
(2)气体A为。若生成A,证明假设或假设可能成立;若不生成A,证明假设成立。
(3)如果生成A,经过步骤②和步骤③后,生成气体B,则B是(填化学式),证明假设成立,写出步骤②的化学方程式。
以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制。以粗盐为原料的“氯碱工业”流程如下: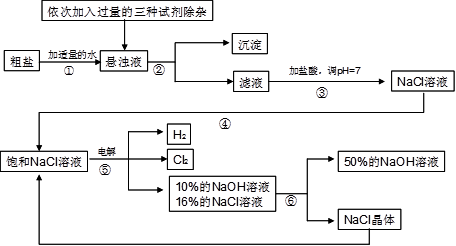
回答下列问题:
(1)氯气、氢氧化钠在工业上有广泛的用途。下列关于氢氧化钠的描述中,错误的是。
| A.能去除油污,可做厨房清洁剂 | B.易溶于水,溶解时放出大量的热 |
| C.水溶液能使石蕊溶液变红 | D.可用作某些气体的干燥剂 |
(2)操作②的名称是,操作④的名称是。
(3)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3溶液必须在BaCl2溶液之(填“前”或“后”)加入。有同学提出用溶液代替BaCl2溶液可达到同样的目的。
(4)电解饱和NaCl溶液的化学方程式是。
(5)该流程中可以循环利用的物质是。