(5分) 以下是某研究小组探究影响化学反应快慢的一些因素的相关数据(常温通常指20℃;)
| 序号 |
过氧化氢% |
过氧化氢g |
温度/℃ |
二氧化锰/g |
氧气/ml |
反应时间/s |
| ① |
5 |
12 |
20 |
0.2 |
125 |
11 |
| ② |
30 |
12 |
20 |
0.2 |
125 |
2 |
| ③ |
30 |
12 |
40 |
/ |
125 |
148 |
| ④ |
30 |
12 |
90 |
/ |
125 |
82 |
(1)通过实验①和②对比可知,化学反应快慢与 有关;
(2)通过实验 和 对比可知,化学反应快慢与温度的关系是 。
(3)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是 。
[注:本题以下为加分部分,回答正确得4分,总分不超过60分。只要求提出一种影响过氧化氢生成氧气的快慢的因素以及相关假设(1分)和实验方案(3分)]
(4)过氧化氢生成氧气的快慢还有与哪些因素有关?请你帮助他们继续探究.
【假设】
【实验方案】
在趣味实验课上,老师将铝片、铜片打磨后,一起插入未成熟的新鲜橙子里面,同学们看到灯泡发光感到很惊奇。老师说这就是水果电池,通常用较活泼的金属做负极,利用橙汁内可以导电的有机酸溶液形成稳定的电流。请你回答下列问题: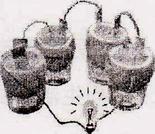
(1)铝、铜可做电极,利用了金属的;
(2)在这个水果电池中能做正极的金属是;
(3)为比较这两种金属的活动性顺序,除铝片和铜片外还需选用的试剂是(写出一种即可)。
以下是初中化学常见的实验装置图,请回答有关问题
(1)写出仪器①的名称________________,写出实验室可用C装置制取的一种单质气体的化学反应方程式;
(2)某同学欲在实验室中用大理石和稀盐酸制取二氧化碳气体,他应选用的发生装置是
(填序号),该反应的化学方程式是;
(3)现有如下资料:实验室用加热固体氯化铵和熟石灰的混合物制取氨气。氨气是一种密度比空气小且有强烈刺激性气味的无色气体,极易溶于水,形成氨水溶液。则实验室制取氨气的发生装置为(填序号):
(4)若用D装置收集氨气,则气体应从端通人(填a或b):
(5)用F装置吸收尾气时,则F装置的好处是。
(6)用B装置比C制取气体的优点是__________________________________________。
竹炭包(见右图)是一种集观赏与空气净化为一体的产品。这种产品可对车内及室内空气中的一氧化碳、甲醛等有害气体进行吸附。某课外小组对竹炭进行初步探究。
[提出问题]竹炭中是否含有碳元素。
[猜想与假设]竹炭中含有碳元素
[查阅资料]①新鲜的血液,遇一氧化碳由鲜红变为暗红。
②氢氧化钠能与二氧化碳发生化学反应。
[设计实验]通过检验竹炭燃烧产物,证明竹炭中含有碳元素。所用装置如下图所示。
(1)A装置的作用为。
(2)实验开始后,C装置中产生白色沉淀,反应化学方程式为,E装置中新鲜的鸡血变为暗红色,证明。
(3)小红认为应在A、B装置间,增加澄清石灰水,目的是。
(4)小明认为可以用右图所示的装置,替换原装置中的E装置,你认为可以吗?主要原因是什么?
。
[初步结论]竹炭中含有碳元素。
[拓展应用] 竹炭细密多孔,牙膏中含有竹炭等成分具有消炎、止痛、化淤、去污等功效,下列有关竹炭牙膏的用途描述正确的。
A.可防癌抗衰老B.虫咬、灼伤可消炎止痛
C.可除去口中异味D.可除衣领袖口等处的汗渍
(13分)木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下: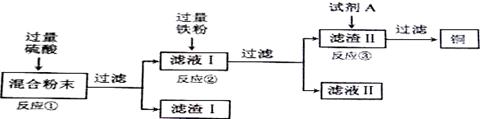
(1)写出下列反应的化学方程式:
反应①:______________________; 反应②:___________________________.
(2)反应①所用的硫酸的质量分数为24.5%.现要配制40g 24.5%的硫酸,需________g 98%的硫酸和_______g水.
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入__________中(填仪器名称),然后__________ (填操作名称),使反应充分进行.
(4)试剂A可选用___________溶液(填一种物质的化学式)
(5)已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
【猜想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有(填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
| 实验方案 |
实现现象 |
结论 |
| ①取一定量的合金粉末,加过量的_______,充分反应后过滤,滤渣备用. |
粉末部分溶解,并有气体放出. |
合金中一定含有. |
| ②取步骤①所得滤渣,加过量的_________,充分反应. |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. |
合金中一定含有. |
【探究结论】猜想3成立.
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.写出铝与稀盐酸反应的化学方程式.
暖宝宝是一种防寒用品,如图所示。暖宝宝中的主要成分有哪些?发热的原因是什么?
(1)小明探究:暖宝宝中的主要成分是什么?
剪开内包装袋,倒出其中的粉末,发现呈黑色。
【提出猜想】该黑色粉末可能含有炭粉、铁粉、二氧化锰、氧化铜、四氧化三铁中的一种或几种。
【初步验证】将磁铁靠近黑色粉末,部分被吸引。
【查阅资料】四氧化三铁具有磁性,能被磁铁吸引;炭粉、二氧化锰不与稀硫酸;氧化铜与稀硫酸反应后溶液呈蓝色。
【得出结论】该黑色粉末可能含有(写物质的名称)。
【进行实验】
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取黑色粉末加足量稀硫酸 |
固体部分溶解,有气泡产生,溶液无蓝色 |
| ② |
取实验①的残渣灼烧,将内壁涂 有澄清石灰水的小烧杯罩在上方 |
澄清石灰水变浑浊 |
由实验①可知,该黑色粉末中肯定含_____________,肯定不含______________。
由实验②可知,该黑色粉末肯定含,写出实验②中澄清石灰水变浑浊的化学
反应方程式_________________________。
(2)小明思考:暖宝宝为什么会发热?
【查阅资料】暖宝宝中的铁粉在空气中发生了缓慢氧化,进而放出热量。由此可见,
人们可以利用化学反应放出的能量,请再举一例:___________________。
(3)人们利用化学反应还可以_______________________。
(4)向盛有100g稀盐酸的烧杯中加入足量的铁粉,充分反应后,得到0.5g氢气。试100g稀盐酸中溶质的质量分数。