氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq)  F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq)  H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是( )
| A.当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) |
B.水电离的热化学方程式为:H2O(1) 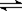 H+(aq)+OH—(aq);△H= +57.3kJ/mol H+(aq)+OH—(aq);△H= +57.3kJ/mol |
| C.当c > 0.1时,一定不存在:c(Na+) = c(F—) |
| D.若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1 |
VL Fe2(SO4)3溶液中含有ag SO42-,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为
A.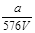 mol/L mol/L |
B.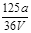 mol/L mol/L |
C.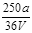 mol/L mol/L |
D.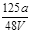 mol/L mol/L |
设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,2.24 L CCl4中含Cl原子数目为0.4NA |
| B.白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA |
| C.1mol氯气参加氧化还原反应,转移的电子数一定为2 NA |
| D.5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA |
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。那么,这种做法的化学原理是
| A.胶体的电泳 | B.血液的氧化还原反应 |
| C.血液中发生复分解反应 | D.胶体的聚沉 |
将某些化学知识用图像表示,可以收到直观、简明的效果。下列图象所表示的化学知识中,明显不正确的是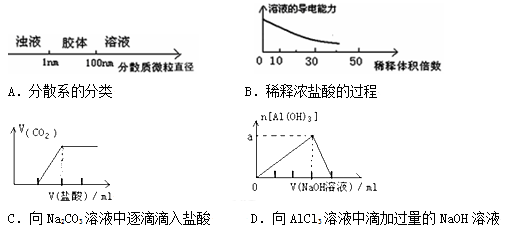
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式为NaAl(OH)2CO3。关于该物质的说法正确的是
| A.该物质属于两性氢氧化物 |
| B.该物质是Al(OH)3和Na2CO3的混合物 |
| C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+ |
| D.该药剂不适合于胃酸过多的胃病患者 |