反应2X(g)+Y(s)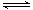 2Z(g) ΔH<0,达到平衡时,下列说法正确的是
2Z(g) ΔH<0,达到平衡时,下列说法正确的是
| A.减小容器体积,平衡不移动 | B.增大Y的量,Z的百分含量增大 |
| C.加入催化剂,X的转化率增大 | D.降低温度,正反应速率增大、逆反应速率减小 |
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是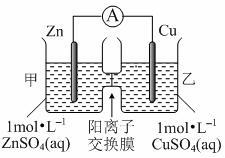
| A.铜电极上发生氧化反应 |
| B.电池工作一段时间后,甲池的c(SO42-)减小 |
| C.电池工作一段时间后,乙池溶液的总质量增加 |
| D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
图Ⅰ的目的是精练铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是
| A.图Ⅰ中a为纯铜 |
| B.图Ⅰ中SO42-向b极移动 |
| C.图Ⅱ中如果a、b间连接电源,则a连接电源负极 |
| D.图Ⅱ中如果a、b间用导线连接,则X可以是铜 |
糕点(如月饼)包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe—3e— =Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O + O2 + 4e—= 4OH— |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按右式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2由此可知,该电池充电时在阴极上发生反应的是
Cd(OH)2+2Ni(OH)2由此可知,该电池充电时在阴极上发生反应的是
| A.Ni(OH)2 | B.Cd(OH)2 | C.Cd | D.NiOOH |
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。电解时,下列有关叙述正确的是(已知氧化性Fe2+<Ni2+<Cu2+)
| A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— = Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |