在1100℃,一定容积的密闭容器中发生反应:FeO(s) + CO(g)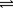 Fe(s) + CO2(g) ΔH ="a" kJ/mol (a >0),该温度下K=0.263,下列有关该反应的说法正确的是
Fe(s) + CO2(g) ΔH ="a" kJ/mol (a >0),该温度下K=0.263,下列有关该反应的说法正确的是
| A.若增加CO的用量,上式中的ΔH增大 |
| B.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| C.若升高温度,则正反应速率加快,逆反应速率减慢,化学平衡正向移动 |
| D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.0263" mol/L |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
下列说法正确的是()
| A.原溶液中c(Fe3+)=0.2 mol·L-1 |
| B.要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ |
| C.SO42-、NH4+、Na+一定存在,CO32-,Al3+一定不存在 |
| D.溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1 |
下列实验事实得出的结论不正确的是()
| 选项 |
实验事实 |
结论 |
| A |
H2可在Cl2中燃烧 |
燃烧不一定有氧气参加 |
| B |
铝箔在酒精灯火焰上加热熔化但不滴落 |
氧化铝熔点高于铝 |
| C |
将SO2通入含HClO的溶液中,生成H2SO4 |
HClO酸性比H2SO4强 |
| D |
向FeCl2溶液中滴入KSCN溶液,在液面出现微红色 |
Fe2+在空气中被氧化 |
下列有关实验操作和现象描述的对应关系正确的是()
| A.向AlCl3溶液中逐滴加入氨水,产生白色沉淀后消失 |
| B.向Na2SiO3溶液中逐滴加入稀盐酸,产生白色胶状物 |
| C.将NaOH溶液逐滴滴入FeSO4溶液中,只观察到白色沉淀 |
| D.将砂纸打磨过的铝箔加热至熔化,熔化的铝以小液滴的形式滴落下来 |
下列离子反应方程式不正确的是()
| A.向氯化铁溶液中投入铜粉: Cu+2Fe3+ ="=" 2Fe2+ + Cu2+ |
| B.碳酸氢铵溶液和足量氢氧化钠溶液混合: HCO3-+OH- ="=" CO32-+H2O |
| C.少量的二氧化碳通入次氯酸钙溶液: Ca2++2ClO-+CO2+H2O="=2HClO+" CaCO3↓ |
| D.铜与稀硝酸反应: 3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O |
Na2FeO4是一种新型水处理剂,可以通过下列反应制取:
湿法制备的主要反应方程为:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4 +2Na2SO4
下列有关该反应的说法错误的是()
| A.两反应中Na2FeO4均为氧化产物 |
| B.Na2FeO4有强氧化性,可消毒杀菌,其还原产物能吸附水中杂质 |
| C.干法中每生成1mol Na2FeO4转移3mol电子 |
| D.碱性条件下,NaClO氧化性大于Na2FeO4 |