某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:

下列说法正确的是( )
| A.原溶液中c(Fe3+)=0.2 mol·L-1 |
| B.要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ |
| C.SO42-、NH4+、Na+一定存在,CO32-,Al3+一定不存在 |
| D.溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温下,0.05 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为0.1 NA |
| B.标准状况下,22.4L苯中含C—H数目为6NA |
| C.常温、常压下,1.6g O2和O3混合物中,氧原子的数目为0.1NA |
| D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA |
右图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是
①Al;②Fe;③C;④Cl2
| A.①②③ | B.②③ | C.①② | D.①②③④ |
在实验室,称取一定量的粗盐经溶解、过滤、结晶等操作,可得到较纯净的食盐。下列图示对应的操作不规范的是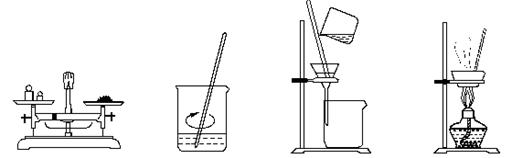
| A.称量 | B.溶解 | C.过滤 | D.结晶 |
下列有关物质性质的应用正确的是
| A.二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 |
| B.二氧化硅具有较强的导电性,可用于制造光导纤维 |
| C.常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 |
| D.金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti |
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
| A.使酚酞变红色的溶液:NH4+、Ba2+、I-、Cl- |
| B.使甲基橙变红色的溶液:Fe3+、K+、NO3-、SO42- |
| C.含有0.1 mol·L-1 FeCl3溶液:Na+、K+、SCN-、NO |
| D.由水电离产生的c(H+)=10-12mol·L-1的溶液:Na+、K+、AlO2-、CO32- |