2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= -99kJ·mol—1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= -99kJ·mol—1.请回答下列问题:
(1)图中A、C分别表示______________________、__________________________ ,E的大小对该反应的反应热有无影响?________________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___________ 理由是_____________________________.
(2)图中△H= _______________ KJ·mol—1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式_________________________________________
(4)如果反应速率υ(SO2)为0.05 mol·L—1·min—1,则υ(O2)= ______________mol·L—1·min—1、υ(SO3)="____________" mol·L—1·min—1;
(5)已知单质硫的燃烧热为296 KJ·mol—1,计算由S(s)生成3 molSO3(g)的△H______________(要求计算过程)。
Fe2O3和Cu2O都是红色粉末,常用作颜料。某化学实验小组通过实验来探究一红色粉末是Fe2O3还是Cu2O或是二者混合物。探究过程如下:
查阅资料:Cu2O是碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设:假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是 ,
(2)若假设2成立,则实验现象是 ,写出发生反应的离子方程式 ,
(3)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含Fe2O3。你认为这种说法合理吗?请回答问题并简述你的理由(不需写反应方程式) 。
下图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性;I是一种金属单质;F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸;C和D是两种常见的强酸。请回答下列问题:
(1)写①的化学方程式______________________________________
(2)写反应②的离子方程式__________________________________
(3)写出将A通入石灰乳的化学方程式________________________
(4)在①②③④⑤⑥中,属于氧化还原反应的有:_______________(填编号)
某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验: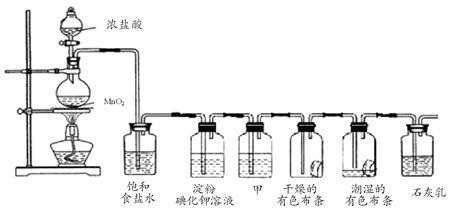
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是 ,反应的离子方程式为 。
(2)若干燥的有色布条不褪色,潮湿的有色布条褪色,则甲中盛放 (填名称)。
(3)C12与石灰乳反应制取漂白粉的化学方程式为 。
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2 L。
利用化合价推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①SO2的性质________________(填序号,下同)
A.只有氧化性 B.只有还原性 C.既有还原性又有氧化性
②SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应后,锰元素被还原成Mn2+,写出上述反应的离子方程式_______________________
(2)Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的离子方程式为_______________为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配置的NaOH溶液反应制备。
①用硫酸亚铁晶体配置上述硫酸亚铁溶液时,还需加入______________来防止Fe2+被氧化。
②除去蒸馏水中溶解的O2常采用_____________的方法
(3)检验Fe3+的方法:_______________________(写出加入试剂的化学式和现象与结论)
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。
(1)硝酸在该反应中的作用是__________________。该反应的还原产物是________________
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________。