(10分)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
N2(g)+3H2(g)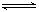 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是________;
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________,密度________。(填“变大”“变小”或“不变”)
(3)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”“小于”或“等于”)原来的2倍。
下表是某食品包装上的说明,表中列出了部分配料。
配料中,富含维生素的是 (填序号,下同),属于调味剂的是 ,属于着色剂的是 ,属于防腐剂的是  。
。
(1)属于人体生命必需微量元素的是__________。(填”Fe”、”H”或 “Na”);
(2)乙烯经加聚反应生成的聚乙烯的结构简式是
_________________________。
(3)钢铁暴露在潮湿空气中发生电化学腐蚀的实质:钢铁表面的水膜与铁组成无数微小的______________________________。
已知某条件下,1molN2(气态)与适量H2(气态)完全反应后生成 NH3(气态),放出92.2 kJ的热量,请写出该反应的热化学方程式:
______________ __________________________________________________
__________________________________________________
现有下列四种物质:①NH4Cl、②Cl2、 ③FeCl3、④NO。其中,能够与氢氧化钙加热条件下反应生成能使湿润的红色石蕊试纸变蓝的气体的是(填序号,下同),遇到KSCN溶液能变红的是,易与空气中氧气反应的是,通常状况下呈黄绿色的是。
③FeCl3、④NO。其中,能够与氢氧化钙加热条件下反应生成能使湿润的红色石蕊试纸变蓝的气体的是(填序号,下同),遇到KSCN溶液能变红的是,易与空气中氧气反应的是,通常状况下呈黄绿色的是。
在Cu+ 4 HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2 H2O的反应中,作为氧化剂的物质是(填化学式),发生了氧化反应的物质是(填化学式);若反应中生成了 1 mol NO2,则需消耗mol浓HNO3。