下表是摘自国家环境监测中心公布的某时间我国部分大城市空气的监测周报.
| 城市 |
污染 指数 |
首要 污染物 |
空气质 量级别 |
城市 |
污染 指数 |
首要 污染物 |
空气质 量级别 |
| 北京 |
92 |
TSP |
Ⅱ |
济南 |
76 |
TSP |
Ⅱ |
| 天津 |
82 |
TSP |
Ⅱ |
武汉 |
83 |
NO x |
Ⅱ |
| 长春 |
103 |
TSP |
Ⅲ |
深圳 |
77 |
NO x |
Ⅱ |
| 上海 |
74 |
NO x |
Ⅱ |
汕头 |
54 |
|
Ⅱ |
| 杭州 |
67 |
TSP |
Ⅱ |
成都 |
87 |
TSP |
Ⅱ |
| 福州 |
42 |
|
Ⅰ |
重庆 |
98 |
SO 2 |
Ⅱ |
| 厦门 |
25 |
|
Ⅰ |
贵阳 |
69 |
TSP |
Ⅱ |
注:TSP:空气中飘尘;NO x :含氮氧化物.
阅读分析上表,回答下列问题:
(1)经济特区中,空气质量最好的城市是_____________,直辖市中空气质量最差的城市是_____________.
(2)最容易出现酸雨的城市是_____________.为防止城市出现酸雨,降低煤燃烧时向大气排放的SO 2 ,工业上将生石灰或石灰石和含硫煤混合使用.请写出燃烧时,有关“固硫”(不使含硫化合物进入大气)反应的化学方程式 ___________________________.
某人设计淀粉利用方案如下图所示: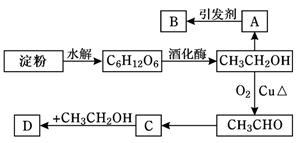
其中:A是乙烯能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
(1)“C6H12O6”的名称是________,A的电子式为__________,C中含有官能团名称;
(2) A→B反应类型_________________;C→D反应类型_________________
(3)写出下列转化的化学方程式
①A→B:,
②C→D:,
③CH3CH2OH→CH3CHO:。
粉煤灰是燃煤电厂的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为38%,还有含量较多的SiO2。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4,有关化学反应方程式:Al6Si2O13+3Na2CO3 →2NaAlSiO4 + 4NaAlO2+3CO2↑,结合上述反应完成下列填空:
(1)上述反应所涉及的元素中,原子核外电子数最多的元素在周期表中的位置是________________,其氧化物属于晶体。
(2)上述元素中有三种元素在元素周期表中处于相邻位置,其原子半径从大到小的顺序为
>>(用元素符号表示)。
(3)二氧化碳分子的空间构型为型。
(4)上述元素中有两种元素是同一主族,可以作为判断两者非金属性强弱的依据的是(填编号)。
a.该两种原子形成的共价键中共用电子对的偏向
b.最高价氧化物熔沸点高低
c.最高价氧化物对应水化物的酸性强弱
d.单质与酸反应的难易程度
能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,通常主要表现为热量的变化。
①下列反应中,属于放热反应的是___________(填序号)。
a. Ba(OH)2·8H2O与NH4Cl混合搅拌
b. 高温煅烧石灰石
c. 铝与盐酸反应
②某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是_______(填“吸热”或“放热”)反应,其离子方程式是_______________。
(2)电能是现代社会应用最广泛的能源之一。
下图所示的原电池装置中,其负极是_____________________,正极上能够观察到的现象是____________________________,正极的电极反应式是_________________________。
原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。
从海水制备金属镁的流程如图所示:
(1)为了节约成本,充分利用海滩资源,用贝壳经过一系列反应可以制得石灰乳,请写出有关反应的化学方程式:__________;__________。
(2)向石灰乳中加入MgCl2溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
(3)从熔点与硬度方面来看,镁合金与镁相比较,其特点有__________。
已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
请回答下列问题:
(1)写出A的结构简式__________,B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,____________________;
④____________________,____________________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E?__________,原因是__________。