在一恒温、恒容密闭容器中充入1mol CO2和3 mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如右图所示。回答下列问题:

(1)Y的化学式是 。
(2)反应进行到3min时,v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率v(H2)= mol·L-1·min-1。
(3)不能判断该反应达到化学平衡状态的依据是 。
| A.容器内各气体的体积比保持不变 | B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) | D.H2转化率为75% |
(4)上述反应达到平衡后,往容器中同时加入1molCO2和1mol H2O(g),此时平衡将 (填“向左”、“向右”或“不”)移动。
(5)上述温度下,反应CH3OH (g) + H2O(g) CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
NA为阿伏加德罗常数,计算1g H2中,电子数目
与0.11molH2SO4电子数相等的二氧化碳的物质的量是
原子的质量、相对原子质量、原子质量数之间的关系
①原子的质量:也称绝对质量,是通过精密的实验测得的。原子的真实质量很小。例如:一种碳原子的真实质量为1.993×10-26Kg
②原子的相对质量:指的是某原子的绝对质量与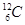 原子质量的
原子质量的 比值
比值
③原子的质量数:原子核中所有质子和中子的相对质量的近似整数值加起来,所得数值叫质量数。
[思考题](1)不同元素的原子,其什么必须不相同?什么可能相同?
(2)请分析Na+的质子数、中子数、质量数、电子数各为多少?
(3)请分析Cl-的质子数、中子数、质量数、电子数各为多少?
(4)已知某元素的阴离子Rn-的原子核中的中子数为(A-x+n),其中A为原子的质量数,则W克Rn-中的电子总数为多少?[NA为阿伏加德罗常数]
元素符号周围不同位置数字的含义 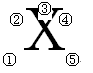
①号位:左下角表示
②号位:左上角表示
③号位:正上方表示
④号位:右上角表示
⑤号位:右下角表示
 的含义
的含义