已知:强酸和强碱在稀溶液中发生反应时的中和热为-57.3 kJ ·mol-1,101 k Pa时辛烷的燃烧热为-5518 kJ· mol-1。则下列热化学方程式书写正确的是( )
| A.H+ + OH-="=" H2O △H =-57.3 kJ · mol-1 |
| B.2NaOH(aq)+ H2SO4(aq) ="=" Na2SO4(aq)+2 H2O(l) △H =-114.6 kJ·mol-1 |
| C.2C8H18(l) + 25O2(g) ="=" 16CO2(g) + 18H2O(g) △H =-11036 kJ·mol-1 |
| D.2C8H18(l) + 25O2(g) ="=" 16CO2(g))+18H2O(l) △H =-5518kJ·mol-1 |
下列溶液中有关微粒的物质的量浓度关系正确的是()
A.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:
c(Na+)>c(Cl-)> c(CH3COOH)
B.等物质的量浓度等体积的硫化钠溶液与硫酸氢钾溶液混合
C(Na+)> C(K+)> C(SO42-)> C(HS-)> C(OH-)>C(H+)
C.pH <7的某二元弱酸的酸式盐NaHA溶液中有c(H+)+2 c(A2-)==c(OH-) +c (H2A)
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
已知AgCl、AgBr的溶解度分别为1.5×10-4g、8.4×10-6 g(20℃)。将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓硝酸银溶液,发生的反应为( )。
| A.只有AgBr沉淀生成 | B.AgCl和AgBr沉淀等量生成 |
| C.AgCl沉淀少于AgBr沉淀 | D.AgCl沉淀多于AgBr沉淀 |
下列有关说法正确的是( )
| A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0 |
C.加热0.1 mol·L-1Na2CO3溶液,CO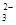 的水解程度和溶液的pH均增大 的水解程度和溶液的pH均增大 |
| D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
类比推理的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论。以下几种类比推理结论中正确的是()
| A.H2SO4为强酸,推出HClO4为强酸 |
| B.Fe3Cl8可以改写为FeCl2·2FeCl3,推出Fe3I8可以改写为FeI2·2FeI3 |
| C.NH3的沸点高于PH3,推出CH4沸点高于SiH4 |
| D.CO2通入Ba(NO3)2溶液中无沉淀生成,推出SO2通入Ba(NO3)2溶液中无沉淀生成 |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3  K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是()
K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是()
| A.生成40.0LN2(标准状况) | B.有0.250molKNO3被氧化 |
| C.转移电子的物质的量为1.25mol | D.被氧化的N原子的物质的量为3.5mol |