低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) 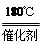 2N2(g)+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是
2N2(g)+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是
| A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.向0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合: c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.向0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: |
c(Na+)>c(NH4+)>c(SO42-)>c(OH-) =c(H+)
下列依据相关实验得出的结论正确的是
| A.加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 |
| B.纤维素的水解产物能够发生银镜反应,说明纤维素是一种还原性糖 |
| C.向某溶液中滴加硝酸酸化的Ba(NO3)2溶液产生白色沉淀,说明该溶液中含有SO42- |
| D.等物质的量浓度的H3PO4溶液的pH比H2SO4溶液大,说明硫比磷的非金属性强 |
新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:
下列有关叙述正确的是
| A.克利贝特的分子式为C28H36O6 |
| B.物质X分子中所有碳原子可能位于同一平面内 |
| C.1 mol物质X最多可以与含2 molBr2的溴水反应 |
| D.用饱和NaHCO3溶液可以鉴别物质X和克利贝特 |
下列有关说法正确的是
| A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B.合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率 |
| C.常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 |
| D.NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+ |
短周期元素原子序数之和为28,X+与Z2-具有相同的核外电子层结构,Y、Z在同一周期。下列推测正确的是
| A.元素Y的最高化合价为+7 |
| B.三种元素的原子半径rZ>rY>rX |
| C.Z的单质比Y的单质更易与H2反应 |
| D.化合物X2Z2中阴阳离子数之比为1: 2 |