三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O  2NO+HNO3+9 HF,下列有关该反应的说法正确的是
2NO+HNO3+9 HF,下列有关该反应的说法正确的是
| A.NF3是氧化剂,H2O是还原剂 |
| B.HF是还原产物 |
| C.还原剂和氧化剂的物质的量之比是2∶1 |
| D.NF3在潮湿的空气中泄漏会产生红棕色气体 |
下列各组的反应,属于同一反应类型的是()
| A.由溴丙烷水解制丙醇;由丙烯和水反应制丙醇 |
| B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 |
| C.由氯乙烷消去制乙烯;由丙烯加溴制1,2-二溴丙烷 |
| D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 |
根据下列事实得出的结论正确的是()
A.试样 产生银镜结论:该试样是醛类 产生银镜结论:该试样是醛类 |
B. 某卤代烃试样 某卤代烃试样 最终的沉淀不是白色; 最终的沉淀不是白色;结论:该卤代烃中不含氯原子 |
C.某 溶液 溶液 冒着白雾 冒着白雾 产生大量白烟; 产生大量白烟;结论:此溶液为浓盐酸 |
D.无色试液 呈黄色;结论:此溶液一定含有钠元素 呈黄色;结论:此溶液一定含有钠元素 |
下列操作正确的是()
| A.把pH试纸浸入溶液中测定溶液的pH |
| B.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 |
| C.苯酚沾在皮肤上立即用酒精擦洗 |
D.用盐酸清洗做 过银镜反应实验的试管 过银镜反应实验的试管 |
2008年质检部门在众多品牌乳制品中检出有毒有机物三聚氰胺[C3N3(NH2)3],在乳制品行业掀起了一场轩然大波,引发了一场关于食品安全问题的大讨论。三聚氰胺是一种重要的有机化工原料,因其含 氮量高而被不法商家用作食品添加剂,以提升食品检测中的蛋白质含量指标(N%),因此三聚氰胺也被人称为“蛋白精”。三聚氰胺遇强酸或强碱水溶液水解,胺基逐步被羟基取代,最后生成三聚氰酸[C3N3(OH)3]。三聚氰酸可用于消除汽车尾气中的NO2。其反应原理为:
氮量高而被不法商家用作食品添加剂,以提升食品检测中的蛋白质含量指标(N%),因此三聚氰胺也被人称为“蛋白精”。三聚氰胺遇强酸或强碱水溶液水解,胺基逐步被羟基取代,最后生成三聚氰酸[C3N3(OH)3]。三聚氰酸可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3  3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 7N2+8CO2+4H2O,下列说
7N2+8CO2+4H2O,下列说 法正确的
法正确的
是()
| A.C3N3(OH)3与HNCO为同一物质 | B.HNCO是一种很强的氧化剂 |
| C.1mol NO2在反应中转移的电子为4mol | D.反应中NO2是还原剂 |
用右图表示的一些物质或概念间的从属关系中不正确的是()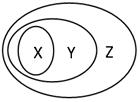
| X |
Y |
Z |
|
| A |
苯的同系物 |
芳香烃 |
芳香族化合物 |
| B |
胶体 |
分散系 |
混合物 |
| C |
电解质 |
离子化合物 |
化合物 |
| D |
碱性氧化物 |
金属氧化物 |
氧化物 |