某新型液晶有机物基元IV的合成线路如下:
(1)Ⅰ的分子式 ,Ⅰ中含氧官能团的名称 ,反应①的类型为 。
(2)CH2=CHCH2Br与NaOH水溶液反应的化学方程式 。
(3)II可发生加聚反应,所得产物的结构简式 。
(4)有关化合物Ⅰ和II的说法中,不正确的是 。
| A.1molⅠ充分燃烧需要消耗6mol O2 | B.1molⅠ最多可消耗2mol NaOH |
| C.1mol II最多与5mol H2发生加成反应 | D.II能使酸性KMnO4溶液褪色 |
(5)一定条件下,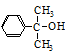 也可与III发生类似反应③的反应,生成有机物V,V的结构
也可与III发生类似反应③的反应,生成有机物V,V的结构
简式是 。
(6)化合物I的同分异构体中,苯环上一溴代产物只有两种,遇FeCl3溶液显紫色,还能发
生银镜反应的化合物有多种,写出其中一种同分异构体的结构简式 。
0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为 。若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2.2—二甲基丁烷,则此烃属于 烃,结构简式为 ,名称是 。
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为:CH3—CH2—O—CH2—CH3,其核磁共振谱中给出的峰值(信号)有两个,如图所示:
(1) 下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是 。
| A.CH3CH3 | B.CH3COOH |
| C.CH3COOCH3 | D.CH3OCH3 |
(2) 化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如右图所示,则A的结构简式为: ,请预测B的核磁共振氢谱上有 个峰(信号)。
(3)用核磁共振氢谱的方法来研究C2H6O的结构,简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是 。
下列各化合物中,属于同系物的是 ,属于同分异构体的是 (填入编号)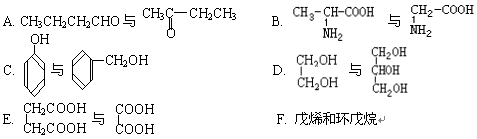
用系统命名法命名下列有机物:
(1)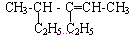 ________________________
________________________
(2)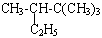 ______________________________________________
______________________________________________
(1)键线式 表示的分子式 ;名称是 。
表示的分子式 ;名称是 。
(2)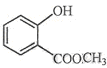 中含有的官能团的名称为 。
中含有的官能团的名称为 。
(3)丁基的4个结构简式为_ 。