在一定温度下,将冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如下图所示。
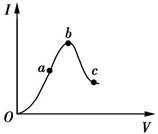
请回答下列问题:
(1)“O”点冰醋酸不能导电的原因是_____________。
(2)a、b、c三点对应的溶液中,C(H+)由小到大的顺序为 。(填字母,后同)
(3)a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是 。
(4) a、b、c三点对应的溶液中,水的电离程度最大的是 。
(5)若使c点对应的溶液中的c(CH3COO-)增大,在下列措施中,可行的是 (填字母,后同)。
A.加热 B.加KOH固体
C.加水 D.加CH3COONa固体
E.加锌粒
(6)在稀释过程中,随着醋酸浓度的降低,下列各量始终保持增大趋势的是 。
A. C(H+) B.H+物质的量 C. C(OH-) D.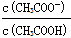
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下: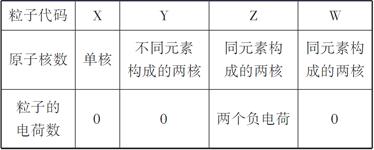
(1)A原子核外比X原子多3个电子,A的原子结构示意图是________;含1 mol X的氧化物晶体中含有共价键数目为________。
(2)Z与钙离子组成的化合物的电子式为________________。
(3)14 g Y完全燃烧放出的热量是141.5 kJ,写出Y燃烧的热化学方程式:______________________________。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(反应条件和其他物质已略):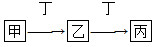
①写出丁在高温下与水反应的化学方程式:__________________;
②组成W的元素的简单氢化物极易溶于水的主要原因是________________________
该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为____________。
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1请回答下列问题:
(1)甲的化学式是________;乙的电子式是________。
(2)甲与水反应的化学方程式是________。
(3)气体丙与金属镁反应的产物是________(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式__________________。有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之______________________。
(已知:Cu2O+2H+=Cu+Cu2++H2O)
(5)甲与乙之间________(填“可能”或“不可能”)发生反应产生H2,判断理由是________。
A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。短周期元素中C的原子半径最大,B、E同族,E的最外层电子数是电子层数的2倍,A的最高价氧化物水化物为H2AO3,D是地壳中含量最高的金属元素。
(1)A的元素符号是________,C2B2的电子式为________。
(2)B、C、D、F的离子半径由大到小的顺序是________(用离子符号表示)。
(3)E和F相比,非金属性强的是________(用元素符号表示),下列事实能证明这一结论的是________(用符号填空)。
①常温下E的单质呈固态,F的单质呈气态 ②气态氢化物的稳定性:F>E ③E和F形成的化合物中,E显正价 ④F单质能与E的氢化物发生置换反应 ⑤E和F的氧化物的水化物的酸性强弱 ⑥气态氢化物的还原性:E>F
(4)把CDB2溶液蒸干所得的固体物质为________(填化学式)。
(5)C和F可组成化合物甲,用惰性电极电解甲的水溶液,电解的化学方程式为__________________________。
(6)A、B、C三种元素组成的常见化合物乙的溶液中,离子浓度由大到小的顺序为________,pH=10的乙溶液中由水电离产生的c(OH-)=________mol·L-1。
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是________,发生反应的离子方程式为________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________。
(2)反应③的反应类型为________,过滤得到的滤渣中,除了过量的锌外还有________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是______________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2。取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于________。
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示: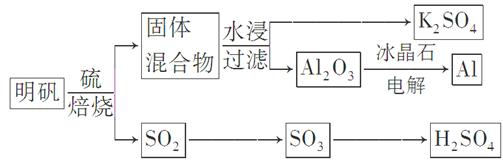 焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是________。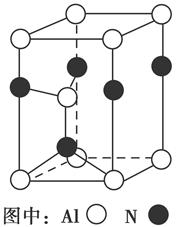
(3)Al2O3在一定条件下可制得AlN,其晶体结构如右图所示,该晶体中Al的配位数是________。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ/mol;
2SO3(g) ΔH1=-197 kJ/mol;
H2O(g)=H2O(l) ΔH2=-44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是________。焙烧948 t明矾(M=474 g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。