下列解释事实的化学方程式或离子方程式正确的是( )
| A.用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3===Ca2++2CH3COO-+CO2↑+H2O |
| B.碳酸氢铵溶液中加入足量氢氧化钡溶液: NH4++HCO3-+2OH-==CO32-+ NH3•H2O +H2O |
| C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I-= 2Fe 2+ + I2 |
D.Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO +2OH-===CaCO3↓+CO +2OH-===CaCO3↓+CO +2H2O +2H2O |
往含0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳慢地通入CO2气体,使CO2气体充分参加反应,当通入气体为6.72 L(S.T.P)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)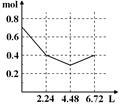

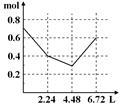
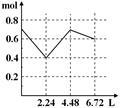
A. B. C. D.
有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是
途径①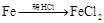 溶液途径②
溶液途径②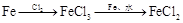 溶液
溶液
途径③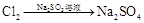 溶液途径④
溶液途径④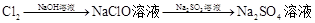
途径⑤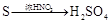 途径⑥
途径⑥
| A.由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole-和3mole- |
| B.由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- |
| C.由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- |
| D.以上说法都不正确 |
如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是
| A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性 |
| B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2 |
| C.反应③④⑤均属于氧化还原反应 |
| D.工业上可利用反应②和反应④回收SO2 |
NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是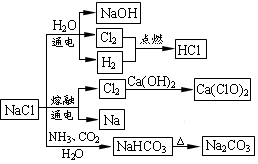
| A.石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂 |
| B.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| C.常温下干燥Cl2能用钢瓶贮运,所以Cl2不与铁反应 |
| D.图中所示转化反应都是氧化还原反应 |
将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
| A.反应速率:两者相同 |
| B.消耗的n(HNO3):后者少 |
| C.气体颜色:前者浅 |
| D.转移电子总数:前者多 |