用NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
| A.常温常压下42g 乙烯和丁烯混合气体中,极性键数为6NA |
| B.100 mL 0.1 mol·L-1 Na2CO3溶液中,离子总数是0.03NA |
| C.标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 |
| D.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是:( )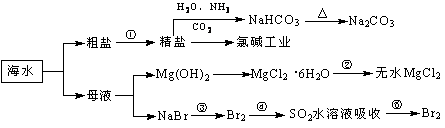
| A.制取NaHCO3的反应是利用其溶解度小于NaCl |
| B.用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C.在第③、④、⑤步骤中,溴元素均被氧化 |
| D.工业上通过电解饱和MgCl2溶液制取金属镁 |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
| A.元素W和M的某些单质可作为水处理中的消毒剂 |
| B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| C.元素Y、Z、W的单质晶体属于同种类型的晶体 |
| D.X、M两种元素只能形成X2M型化合物 |
LiAlH4(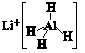 )、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法不正确的是( )
)、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法不正确的是( )
| A.LiH与D2O反应,所得氢气的摩尔质量为4 g/mol |
| B.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子 |
| C.LiAlH4溶于适量水得到无色溶液,化学方程式可表示为:LiAlH4+2H2O===LiAlO2+4H2↑ |
| D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 |
下列离子方程式与所述事实相符且正确的是( )
| A.漂白粉溶液在空气中失效: ClO-+CO2+H2O=HClO+HCO3- |
B.用浓盐酸与MnO2反应制取少量氯气: MnO2+2H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
| C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
3ClO-+2Fe(OH)3===2FeO42-+3Cl-+H2O+4H+
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A.标准状况下,11.2 L氯仿中含有C—Cl键的数目为1.5 NA |
| B.常温下,42 g丁烯和环丙烷的混合气体中含有的碳碳单键数目为3NA |
| C.常温下,1 mol SiC中含有Si—C键的数目为4NA |
| D.常温常压下,17 g甲基(—14CH3)所含的中子数为9 NA |