(12分) NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号)。
| A.NaCl | B.NH4Cl | C.HNO3 | D.浓H2SO4 |
(4)请配平以下化学方程式:
Al+ NaNO3+ NaOH=== NaAlO2+ N2↑+ H2O。若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________L。
(5)在微生物的作用下, NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是 。
9.5g MgCl2溶于水配成100mL溶液,所得溶液的物质的量浓度为 ,取溶液25.0mL,稀释到500mL,此时溶液中Cl-的物质的量浓度为 ,在这两个实验中除了用烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是 。
有10.2克镁铝合金恰好溶于250mL 4mol·L-1的盐酸中,现加入2mol·L-1的氢氧化钠溶液。请回答:
(1)要使产生的沉淀的质量最大,需加入的氢氧化钠溶液的体积是mL
(2)要使产生的沉淀只有氢氧化镁,至少需加入的氢氧化钠溶液的体积是mL
现有金属单质A、B、C和气体甲 、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。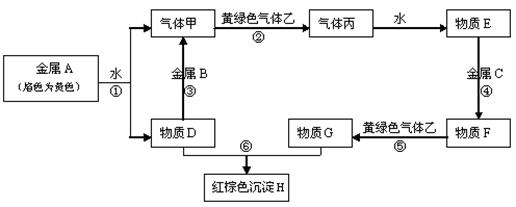
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A 、 B 、 C、
F 、 H 、乙
(2)写出下列反应离子方程式:
反应①
反应③
反应⑤
反应⑥
洪灾过后,饮用水的消毒杀菌成为抑制大规模 传染性疾病爆发的有效方
传染性疾病爆发的有效方 法之一。漂白粉是常用的消毒剂。
法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的主要成分(填化学式)有效成分是(填化学式)。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方为。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)。
1)49 g硫酸的物质的量为mol,若在水中完全电离可产生 molH+ , ______mol
molH+ , ______mol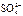 .若有一定量的硫酸完全电离产生
.若有一定量的硫酸完全电离产生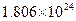 个
个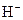 ,此硫酸的质量为 _______g.
,此硫酸的质量为 _______g.
(2)标准状况下,11.2L的H2S气体质量为17g,则H2S的摩尔质量是,相对分子质量为; 等物质的量的NH3与H2S质量比为; 1.7g氨气与mol H2O含有的电子数相等。