浓度为2mol/L的氢溴酸溶液VL,欲使其浓度变为4mol/L,下列方法可行的是( )
| A.通入标况下的HBr气体44.8L |
| B.将溶液加热蒸发浓缩至0.5VL |
| C.蒸发掉0.5VL水 |
| D.加入10mol/L氢溴酸0.6VL,再将溶液稀释至2VL |
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是 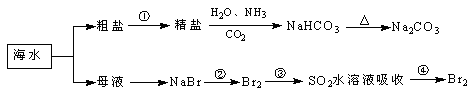
| A.工业上通过电解熔融状态MgCl2制取金属镁 |
| B.用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C.在第②、④步骤中,溴元素均被氧化 |
| D.制取NaHCO3的反应是利用其溶解度小于NaCl |
根据表中信息判断,下列选项不正确的是()
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO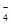 … … |
Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO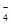 >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中不正确的是()
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.阳极区pH增大 |
| C.图中的b>a |
| D.该过程中的产品主要为H2SO4和H2 |
下列说法正确的是
| A.若2H2(g)+O2(g) = 2H2O(g) ΔH=" -483.6" kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1 |
| B.原子弹爆炸是放热反应 |
| C.若C(石墨,s) = C(金刚石,s) ΔH>0,则石墨能量低且键能小 |
| D.由BaSO4(s) + 4C(s) =" 4CO(g)" + BaS(s) △H1 = +571.2kJ•mol-1 ① |
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) △H2 = +226.2kJ•mol-1 ②
可得反应C(s) + CO2(g) =" 2CO(g)" 的△H = +172.5kJ•mol-1
设NA代表阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 |
| B.1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA |
| C.常温常压下42g 乙烯和丁烯混合气体中,极性键数为6NA |
| D.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |