在短周期中,R原子最外层电子数是其次外层电子数的3倍,下列说法不正确的是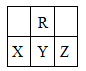
| A.原子半径大小:X >Y>Z |
| B.氢化物的稳定性:X >Y |
| C.化合物YR2能使品红溶液褪色 |
| D.X、Y、Z三种元素最高价氧化物的水化物的酸性最强的是Z |
下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
SO2通入溴水中 |
溶液褪色 |
SO2有漂白性 |
| B |
将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 |
溶液变红 |
Fe(NO3)2样品已氧化变质 |
| C |
向饱和碳酸钠溶液中通入CO2 |
有晶体析出 |
溶解度: NaHCO3>Na2CO3 |
| D |
向盛有少量NaHCO3的试管中滴加草酸溶液 |
有气泡产生 |
酸性:草酸>碳酸 |
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有4个电子,Y是地壳中含量最高的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是
| A.X、Y、Z、W四种元素的最外层电子数之和为18 |
| B.原子半径由大到小的顺序:W>Z>Y>X |
| C.单质的熔点:W>Z |
| D.简单气态氢化物的稳定性:X>Y>W |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA |
| B.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| C.1.8 g D2O中含有的质子数和电子数均为NA |
| D.0.1molNa完全被氧化生成Na2O2时,转移的电子数目为0.1NA |
下列离子方程式书写正确的是
| A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+==Fe2++2Fe3++4H2O |
| B.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O ="=HClO+" HSO3- |
| C.向MgSO4溶液中滴加Ba(OH)2溶液:Ba2+ + SO42-==BaSO4↓ |
| D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全: |
Ba2+ + 2OH- + NH4+ + H+ + SO4 2- ="=" BaSO4↓+ NH3·H2O + H2O
一定条件下,等物质的量的下列物质分别与足量的浓盐酸反应,产生Cl2的物质的量最多的是
| A.MnO2 | B.KClO3 | C.KMnO4 | D.Ca(ClO)2 |