工业上以CuFeS2为原料冶炼铜的主要反应为①2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣);
Cu2S+3SO2+2FeO(炉渣);
②2Cu2S+3O2 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S 6Cu+SO2↑。下列说法错误的是( )
6Cu+SO2↑。下列说法错误的是( )
| A.由1 mol CuFeS2生成1mol Cu,共消耗2.75 molO2 |
| B.该冶炼方法中产生大量的有害气体SO2,可回收用于制备硫酸 |
| C.在反应③中,Cu2S既是氧化剂,又是还原剂 |
| D.在反应①中,SO2既是氧化产物,又是还原产物 |
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2 + Pb + 2H2SO4 = 2PbSO4+ 2H2O,根 据此
据此 反应判断下列叙述中正确的是()
反应判断下列叙述中正确的是()
| A.PbO2是电池的负极 |
B.负极的电极反应式为:Pb + SO42- -  2e - = PbSO4 2e - = PbSO4 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
在室温下将pH=2的硫酸溶液与pH=12的烧碱溶液混合溶液后溶液pH=3,则硫酸与烧碱溶液的 体积之比是()
体积之比是()
| A.9:2 | B.11:9  |
C.9:4 | D.9:11 |
25 ℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是()
| A.c(NH+4)= c(SO2-4) | B.c(NH+4)>c(SO2-4) |
| C.c(NH+4)<c(SO2-4) | D.c(OH-)+c(SO2-4)= c(H+)+c(NH+4) |
已知:C(s)+CO2(g)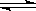 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是()
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是()
| A.升高温度和减小压强 | B.降低温度和减小压强 |
| C.降低温度和增大压强 | D.升高温度和增大压强 |
向CH3COOH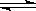 CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是()
CH3COO-+ H+ 的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变大的是()
| A.NH4Cl固体 | B.CH3COONa | C.NH3·H2O | D.Zn粉 |