向60 mL Na2SO4溶液中加入BaCl2溶液,有关数据见下表:
下列有关说法不正确的是( )
| A.混合前,BaCl2溶液的物质的量浓度为0.10 mol·L-1 |
| B.混合前,Na2SO4溶液的物质的量浓度为0.15 mol·L-1 |
| C.3号实验中沉淀的质量x为1.398 g |
| D.完全沉淀60 mL Na2SO4溶液消耗BaCl2溶液的体积为80 mL |
右表是元素周期表中短周期元素的一部分,A、D两元素原子核内质子数之和为23。下列有关说法中,不正确的是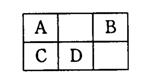
A.气态氢化物的沸点:A>C
B.气态氢化物分子的稳定性:B>D
C.气态氢化物水溶液的酸性:A>B
D.最高价氧化物对应水化物的酸性:D>C
以下判断,结论正确的是
有机化合物与人类的生活密切相关。以下叙述中,正确的是
①乙醇和乙酸都是常用调味品的主要成分②米酒变酸的过程涉及了氧化反应③光导纤维和棉花的主要成分均是纤维素④“人造羊毛”蓬松卷曲而柔软,弹性和保暖性好,是一种合成纤维⑤用加酶洗衣粉洗涤毛织品效果更好
| A.①②④ | B.②③⑤ | C.①②③ | D.①④⑤ |
一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O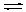 CH3COOH+OH-,下列说法正确的是
CH3COOH+OH-,下列说法正确的是
| A.加入少量NaOH固体,c(CH3COO-)增大 |
| B.加入少量FeCl3固体,c(CH3COO-)减小 |
| C.稀释溶液,溶液的pH增大 |
| D.加入适量醋酸得到的酸性混合溶液:c (Na+)>c(CH3COO-)>c(H+)>c(OH-) |
关于下列图示的说法中正确的是 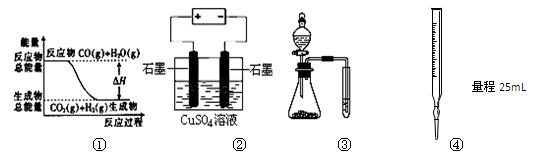
A.图①表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的ΔH大于0 CO2(g)+H2(g)”中的ΔH大于0 |
| B.图②为电解硫酸铜溶液的装置,一定时间内两电极产生单质的物质的量之比一定为1︰1 |
| C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验 |
| D.图④量取0.10mol•L-1 KOH 20.00mL |