(18分)次氯酸钠(NaClO)和亚氯酸钠(NaClO3)都是重要的含氯消毒剂。
(1)NaClO2中,氯元素的化合价为________。
(2)某同学在实验室探究并制作一种家用环保型消毒液(NaClO)发生器,设计了如图的装置,用石墨作电极电解饱和氯化钠溶液。
①通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源有b电极名称为_________(填“正”、“负”、“阴”或“阳”)投。
②装置中发生反应的有关化学方程式为________;充分电解后溶液中各离子浓度由大到小顺序为____。
③请说出使用该装置生产消毒液的一个优点和一个注意事项___________________。
(3)化学课外活动小组为测定某品牌“84消毒液”中NaClO的含量(单位体积溶液含有 NaCIO的质量),做了如下实验。已知:ClO-+2I-+2H+=Cl-+I2+H2O I2+2S2O32-=2I-+S4O62-
取10 mL该消毒液于锥形瓶中,迅速加入适量的硫酸酸化的碘化钾溶液,密封、充分混合,暗处放置几分钟。然后加入几滴淀粉溶液,用c mol/L的硫代硫酸钠(Na2S2O3) 标准溶液滴定,平均用去VmL硫代硫酸钠溶液。则该“84消毒液”中NaCIO的含量为_________g/mL(用含c、V的式子表示)。
(4)以下是过氧化氢法生产亚氯酸钠的工艺流程图:
己知:(i)NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
(ii)纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(iii) HClO2可看成是强酸。
①发生器中发生反应的离子方程式为__________,在发生器中鼓入空气的作用可能是_____。
②吸收塔内的反应的化学方程式为__________________。在吸收塔中为防止被还原成NaCI,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂_________(填序号)。
A.Na2O2 B.Na2S C.FeCl2
③从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是_________(填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
完成并配平下列化学方程式□FeO + □HNO3——□Fe(NO3)3 + NO↑+ □,
该反应中氧化剂是,当生成2mol NO时,转移的电子数为NA。
氨分子的结构是型;实验室制取氨气的化学方程式为,检验氨气是否收集满的常用方法是。
由A和B两种盐组成的混合物,进行了下列实验: 
试判断,A、B分别是A;B 。
写出实验过程中 加水时发生反应的离子方程式:。
加水时发生反应的离子方程式:。
除去括号内的杂质,写出所加试剂的化学式和相关反应的离子方程式。
(1)Cl-(SO42-), ;
;
(2)SO42-(CO32-),;
(3)NaCl(NaOH),;
 (4)Fe2+(Cu2+),;
(4)Fe2+(Cu2+),;
已知A、B是常见的气体单质且B呈黄绿色,F遇KSCN溶液变血红色,各物质之间的转化关系如右图所示。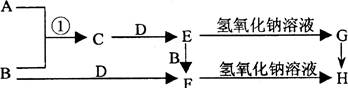
(1)写出下列各物质的化学式:D、E、G 。
(2)写出反应①的化学方程式:。
写出F→H的离子方程式 。
(3)描述G→H反应的现象。