工业上用金红石(主要成分TiO2)制金属钛可通过以下反应进行:
①TiO2+2C+2Cl2 TiCl4+2CO ②TiCl4+2Mg
TiCl4+2CO ②TiCl4+2Mg 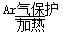 Ti+2MgCl2
Ti+2MgCl2
对于上述两个反应的叙述正确的是
| A.都是氧化还原反应 | B.都是置换反应 |
| C.反应中钛元素都被还原 | D.加热时金属钛和氩气(Ar)能反应 |
25℃和1.01×105Pa,反应2N2O5(g) = 4NO2(g) + O2(g);△H=" +" 56.76 kJ·mol-1能自发进行反应的原因是
| A.是吸热反应 |
| B.是放热反应 |
| C.是熵减少的反应 |
| D.熵增大效应大于能量效应 |
已知450℃时,反应H2(g)+I2(g)  2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
| A.50 | B.0.02 | C.100 | D.无法确定 |
对平衡CO2(g) CO2(aq) .△H=-19.75KJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
CO2(aq) .△H=-19.75KJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
| A.升温增压 | B.降温减压 |
| C.升温减压 | D.降温增压 |
根据热化学方程式:S(s) + O2(g)= SO2(g);△H=akJ·mol-1(a=-297.2),分析下列说法中不正确的是
| A.S(s)在O2(g)中燃烧的反应是放热反应 |
| B.S(g) + O2(g)= SO2(g);△H=bkJ·mol-1,则a<b |
| C.1mol SO2(g)所具有的能量低于1mol S(s)与1mol O2(g)所具有的能量之和 |
| D.16克固体硫在空气中充分燃烧,可放出148.6kJ的热量 |
可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A 3v正(N2)=v正(H2) B v正(N2)=v逆(NH3)
C 2v正(H2 )=3v逆(NH3) D v正(N2)=3v逆(H2)