三氟化氮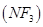 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法正确的是
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法正确的是
| A.NF3是氧化剂,H2O是还原剂 |
| B.NF3在潮湿空气中泄漏会看到红棕色气体 |
| C.每消耗0.2mol氧化剂,可收集到5.418L气体 |
| D.若生成1molHNO3,则转移NA个电子 |
化学与生产、生活密切相关,下列说法不正确的是
| A.合成纤维和光导纤维都属于新型无机非金属材料 |
| B.“地沟油”禁止食用,但经过加T处理后,可以用来制取肥皂和生物柴油 |
| C.大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 |
D.2015年10月我国科学家屠呦呦获诺贝尔医学、生理学奖,她发现、创制的药物青篙素 是治疗疟疾的特效药,青篙素的分子式为C15H22O5 是治疗疟疾的特效药,青篙素的分子式为C15H22O5 |
下图所示与对应叙述相符的是()
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y Z Z |
| B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 |
| C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C- |
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质。
下列分析不正确的是()
| A.电子经外电路流向Pt电极 |
| B.电池工作时,电解质中Ag+数目减少 |
| C.正极反应:Cl2+2e—+2Ag+ = 2AgCl |
| D.空气中c(Cl2)越大,Ag极消耗速率越快 |
向18.4g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3g沉淀.另取等质量的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为()
| A.7.84L | B.6.72L | C.4.48L | D.无法计算 |
已知:①CH3OH(g) +3/2O2(g)=CO2(g)+2H2O(g) △H=-akJ·mol一1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-bkJ·mol一1
③CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-ckJ·mol一1
则下列叙述正确的是()
| A.由上述热化学方程式可知b>c |
| B.甲烷的燃烧热为bkJ/mol |
| C.2CH3OH(g)=2CH4(g) +O2(g) △H=2(b一a)KJ∙mol一1 |
| D.当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O(1)时,放出的热量为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol |