下列说法正确的是( )
| A. HF、HCl、HBr、HI的熔点沸点依次升高。 |
| B. H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。 |
| C.乙醇分子与水分子之间只存在范德华力。 |
| D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
设NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.标准状况下,22.4L CHCl3含有的分子数为NA |
| B.0.1mol/L的NH4NO3溶液中含有的氮原子数为0.2NA |
| C.1molFe2+与足量的H2O2溶液反应,转移2NA个电子 |
| D.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
下列叙述正确的是
| A.溶液和胶体的本质区别是有无丁达尔效应 |
| B.明矾在水中能形成Al(OH)3胶体,可作净水剂 |
| C.玻璃、水泥和光导纤维的主要成分都是硅酸盐 |
| D.将SO2通入品红溶液,溶液褪色后加热恢复原色,将SO2通入溴水,溴水褪色后加热也恢复原色 |
已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g) N2O4 (g)△H<0。一段时间后相继达到平衡状态。下列说法中正确的是
N2O4 (g)△H<0。一段时间后相继达到平衡状态。下列说法中正确的是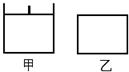
| A.平衡时NO2体积分数:甲<乙 |
| B.达到平衡所需时间,甲与乙相等 |
| C.该反应的平衡常数表达式K=c(N2O4)/c(NO2) |
| D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态 |
下列依据相关实验得出的结论正确的是
A.在0.1mol·L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热后红色加深,说明盐类水解反应是吸热反应 |
B.用铂丝蘸取少量某溶液进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,该溶液一定是钾盐溶液 |
| C.向某FeCl2溶液中加入KSCN溶液,观察到溶液呈血红色,说明该溶液中FeCl2已全部被氧化 | |
| D.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定含有CO32- |
常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是
| A.c(CO32—)>c(H2CO3) |
| B.c(Na+)>c(HCO3—)>c(OH―)>c(H+) |
| C.c(Na+)+c(H+)=c(HCO3—)+c(CO32—)+c(OH―) |
| D.c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3) |