把0.6 mol X气体和0.4 mol Y气体混合于2L容器中使它们发生如下反应,3X(g)+Y(g)  nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式中n的值是( )
nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式中n的值是( )
| A.1 | B.2 | C.3 | D.4 |
利用实验器材(规格和数量不限),能完成相应实验的一项是
| 实验器材(省略夹持装置) |
相应实验 |
|
| A |
烧杯、玻璃棒、蒸发皿 |
硫酸铜溶液的浓缩结晶 |
| B |
烧杯、玻璃棒、胶头滴管、滤纸 |
用盐酸除去硫酸钡中的少量碳酸钡 |
| C |
烧杯、玻璃棒、胶头滴管、容量瓶 |
用固体氯化钠配制0.5mol/L的溶液 |
| D |
烧杯、玻璃棒、胶头滴管、分液漏斗 |
用溴水和CCl4除去NaBr溶液中的少量NaI |
标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
| A.w=17c/(1 000ρ) | B.w=17V/(17V+22 400) |
| C.c=1 000Vρ/(17V+22 400) | D.ρ=(17V+22 400)/(22.4+22.4V) |
某反应体系中存在下列六种物质:As2S3、HNO3、H2SO4、NO、H3AsO4和H2O,已知其中As2S3是反应物之一。下列说法不正确的是
| A.该反应属于氧化还原反应 |
| B.此反应中只有砷元素被氧化,只有氮元素被还原 |
| C.HNO3、H2O是反应物,H2SO4、NO、H3AsO4是生成物 |
| D.HNO3、H2SO4、H3AsO4都是最高价氧化物对应的水化物 |
下列反应的离子方程式书写正确的是
A.将Al条投入NaOH溶液中:Al+OH-+H2O === AlO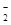 +H2↑ +H2↑ |
B.铜溶于稀硝酸中:Cu+4H++2NO === Cu2++2NO2↑+2H2O === Cu2++2NO2↑+2H2O |
C.碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO +OH- === CO +OH- === CO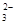 +H2O +H2O |
| D.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸: |
CO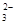 +CH3COOH === CH3COO-+HCO
+CH3COOH === CH3COO-+HCO
有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是
① Fe+Cu2+===Fe2++Cu ② Ba2++2OH-+2H++SO ===BaSO4↓+2H2O
===BaSO4↓+2H2O
③ Cl2+H2O===H++Cl-+HClO ④ CO +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
⑤ Ag++Cl-===AgCl↓
| A.只有③ | B.②③ | C.③⑤ | D.①④ |