有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是
① Fe+Cu2+===Fe2++Cu ② Ba2++2OH-+2H++SO ===BaSO4↓+2H2O
===BaSO4↓+2H2O
③ Cl2+H2O===H++Cl-+HClO ④ CO +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
⑤ Ag++Cl-===AgCl↓
| A.只有③ | B.②③ | C.③⑤ | D.①④ |
分子式为C5H12O,且分子结构中只含有2个甲基和1个羟基的有机物共有(不考虑立体异构)()
| A.3种 | B.4种 | C.5种 | D.6种 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是()
| A.标准状况下,1 mol NO与0.5 mol O2混合后气体的体积为22.4 L |
| B.1L 0.5 mol·L-1 NaF溶液中含有的F—数目为0.5NA |
| C.7.8g Na2S和Na2O2晶体混合物中共含有0.1NA个阴离子 |
| D.12g石墨晶体中正六边形的数目为3NA |
下列说法不正确的是()
| A.在船舶的外壳装上镁合金或锌块保护钢铁设备被称为牺牲阳极的阴极保护法 |
| B.赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 |
| C.海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法等 |
| D.乙烯的产量可以用来衡量一个国家的石油化工发展水平 |
已知相同条件下HF的电离程度大于CH3COOH。同温度下对于同浓度、同体积的CH3COONa溶液和NaF溶液,下列说法正确的是
| A.CH3COONa溶液中存在的离子只有:CH3COO-、Na+ |
| B.在形成CH3COONa溶液的过程中,存在着多个电离、水解过程,其中以CH3COO-的水解过程为主 |
| C.HF的电离程度大,意味着NaF溶液中,F-对水的电离平衡的促进作用小 |
| D.CH3COONa溶液的pH大于NaF溶液的pH, 这是由于CH3COOH电离出的c(H+)更小造成的 |
实验室制取甲酸乙酯的反应为: HCOOH+CH3CH2OH HCOOCH2CH3+H2O
HCOOCH2CH3+H2O
反应在该条件下进行时各物质的浓度(mol・L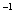 )随时间的变化如下表:
)随时间的变化如下表:
| 时间(min) |
HCOOH |
CH3CH2OH |
HCOOCH2CH3 |
H2O |
| 0 |
0.3 |
0.7 |
0 |
0.3 |
| 10 |
0.23 |
a |
b |
c |
| 20 |
0.2 |
0.6 |
0.1 |
0.4 |
有关物质在101.3KPa时沸点如下:
| HCOOH |
CH3CH2OH |
HCOOCH2CH3 |
H2O |
|
| 沸点(℃) |
101 |
78.5 |
54 |
100 |
该反应的化学平衡常数表达为K=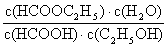 ;有关下列叙述不正确的是
;有关下列叙述不正确的是
A.由题给条件不能判断出K值随温度变化是增大还是减小
B.表中a应该等于0.63 mol・L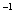
C.已知50℃下,K=1/3,可由此判断出20min时反应还未达到平衡
D.在起始浓度相同的情况下,要提高产率可采取的措施是适当升高温度将甲酸乙酯蒸出