在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下
表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.该温度下此反应的平衡常数K=1.44
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
根据有机化合物的命名原则,下列命名正确的是
A. 2-甲基-3-戊烯 2-甲基-3-戊烯 |
B.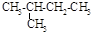 异丁烷 异丁烷 |
| C.CH3CH(C2H5)CH2CH2CH32-乙基戊烷 |
| D.CH3CH(NO2)CH2COOH 3-硝基丁酸 |
醋酸溶液中存在电离平衡CH3COOH H++ CH3COO-,下列叙述不正确的是
H++ CH3COO-,下列叙述不正确的是
| A.醋酸溶液中离子浓度的关系满足:c(H+) = c(OH-) + c(CH3COO-) |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图。下列对该实验的描述错误的是
| A.不能用水浴加热 |
| B.长玻璃管起冷凝回流作用 |
| C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 |
| D.加入过量乙酸可以提高1-丁醇的转化率 |
下列各图中,表示正反应是吸热反应的是
将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,仍未见有沉淀生成,X、Y可能是
| 选项 |
X |
Y |
| A |
SO2 |
H2S |
| B |
Cl2 |
CO2 |
| C |
NH3 |
CO2 |
| D |
SO2 |
NO2 |