降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实
验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生
反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反
应是 (填“吸热”或“放热”)反应。
②500℃达平衡时,CH3OH的体积分数为 。
(2)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述(1)中反应的逆反应。
已知:起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
KMnO4和浓盐酸反应也会生成氯气。其变化可表述为:



 (1)请完成该化学方程式并配平(未知物化学式和化学计量数填入框内)
(1)请完成该化学方程式并配平(未知物化学式和化学计量数填入框内) (2)浓盐酸在反应中显示出来的性质是(填写编号)
(2)浓盐酸在反应中显示出来的性质是(填写编号) ①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
A、B、C、D四种短周期主族元素在周期表里的相对位置如下图所示。已知他们的原子序数总和为46,则: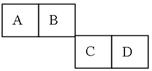
(1)C元素形成的离子结构示意图是:;
(2)元素B的气态氢化物的结构式为;
(3)A与D所形成的最简单化合物中含键,电子式为。
(4)由B、D两氢化物相互作用所生成的物质是,晶体类型为。
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。
结合有关知识,回答下列问题:
(1)汽油是低沸点的烷烃,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为。
(2)乙醇分子中的官能团是_______。(填名称)
(3)在试管里加入2mL乙醇。把一端弯成螺旋状的铜丝放在酒精外焰中加热,使铜丝表面生成一薄层氧化铜(黑色),立即把它插入盛有乙醇的试管里(如右图),取出铜丝,可以观察到铜丝表面的变化是,反应的化学方程式是。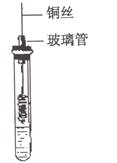
(12 分)在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mo
分)在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mo l SO2进行可逆反应:2SO2(g)+ O2(g)
l SO2进行可逆反应:2SO2(g)+ O2(g) 2SO3(g),2 min后测得O2的物质的量为1.6 mol,则:
2SO3(g),2 min后测得O2的物质的量为1.6 mol,则:
(1)2 min内,SO2的物质的量减少了mol,SO3的物质的量增加了mol;
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=;
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)=。
下列是元素周期表的前三周期中的部分元素:
族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 一 |
H |
He |
||||||
| 二 |
Li |
C |
N |
O |
F |
|||
| 三 |
Na |
Mg |
S |
Cl |
(1)这些元素中,最活泼的元素是,最不活泼的元素是;
(2)原子结构示意图 所表示的原子是。其单质最硬的元素为。
所表示的原子是。其单质最硬的元素为。
(3)Na和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为NaOHMg(OH)2 (填“大于”或“小于”);
(4)请写出由上表第三周期元素形成的一种离子化合物的化学式。